题目内容
15.下列反应用于工业生产的是( )| A. | 氯气与石灰乳反应制漂白粉 | B. | 钠在氯气中燃烧生成氯化钠 | ||
| C. | 氯化铵与氢氧化钙共热制氨气 | D. | 浓盐酸与二氧化锰共热制氯气 |
分析 A.氯气和石灰乳反应生成次氯酸钙、氯化钙;
B.采用海水晒盐的方法制取氯化钠;
C.工业上用氮气和氢气制取氨气;
D.工业上用电解饱和食盐水的方法制取氯气.
解答 解:A.漂白粉的有效成分是次氯酸钙,氯气和石灰乳反应生成次氯酸钙、氯化钙,石灰乳较廉价,所以适用于工业生产,故A正确;
B.采用海水晒盐的方法制取氯化钠,用钠燃烧法制取氯化钠,成本高,故B错误;
C.在高温高压、催化剂条件下,工业上用氮气和氢气制取氨气,故C错误;
D.工业上用电解饱和食盐水的方法制取氯气、氢氧化钠,用浓盐酸与二氧化锰共热制氯气,成本高,故D错误;
故选A.
点评 本题以化学反应为载体考查了理论与实际,工业生产要考虑成本问题,根据物质间的反应结合成本分析解答,题目难度不大.

练习册系列答案
相关题目
5.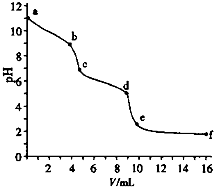 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )
 用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )
用已知浓度的盐酸滴定未知浓度的Na2CO3溶液.用 pH传感器测得混合溶液的pH变化曲线如图(已知:饱和CO2溶液pH为5.6),下列说法正确的是( )| A. | a处发生的离子反应:CO32-+H2O=HCO3-+OH- | |
| B. | 在pH=6时,c(Na+)>c(HCO3-)>c(CO32-) | |
| C. | 在pH=7时,c(Na+)=c(Cl-) | |
| D. | c→d发生的主要离子反应:CO32-+H+=HCO3- |
6.从松树中分离得到的松柏醇,其结构简式为: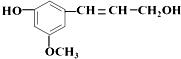 它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
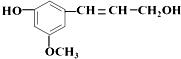 它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )
它既不溶于水,也不溶于NaHCO3溶液.能够跟1mol该化合物起反应的H2或HBr的最大用量分别是( )| A. | 1mol﹑2mol | B. | 4mol﹑4mol | C. | 4mol﹑2mol | D. | 4mol﹑1mol |
3.在相同的温度和压强下,4个容器中分别装有4种气体.已知各容器中的气体和容器的容积分别是a.CO2,100mL;b.O2,200mL;c.N2,400mL;d.CH4,600mL.则4个容器中气体的质量由大到小的顺序是( )
| A. | c>d>b>a | B. | b>a>d>c | C. | a>b>c>d | D. | d>c>a>b |
20.20gA物质和14gB物质恰好完全反应,生成8.8gC物质、3.6gD物质和0.2molE物质,则E物质的摩尔质量为( )
| A. | 100 g•mol-1 | B. | 108 g•mol-1 | C. | 55 g•mol-1 | D. | 96 g•mol-1 |
7.常温下,下列各组物质中,B既能与A反应又能与C反应的是( )
| A | B | C | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 稀盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A. | ①③ | B. | ①④ | C. | ②④ | D. | ②③ |
5.aA(g)+bB(g)?cC(s)+dD(g)△H<0,有下列判断,其中正确的是( )
| A. | 若温度不变,容器体积扩大一倍,此时A的浓度是原来的0.48倍,则a+b大于d | |
| B. | 若从正反应开始平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 若平衡体系中气体M mol,再充入bmolB,达到平衡气体量为(M+b)mol,则a+b=c+d | |
| D. | 若a+b=d,则当容器内温度上升时,平衡向左移动,容器中气体的压强不变 |
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为:
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为: .
. ,
, 某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.