题目内容
5.出去下列各组物质中的杂质(括号内为杂质),采用方法不正确的是( )| A. | NaCl(NH4Cl):加热 | B. | FeCl2(FeCl3):铁粉 | ||
| C. | AlCl3(MgCl2):加氨水 | D. | Fe2O3(Al2O3):加氢氧化钠溶液 |
分析 A.加热氯化铵分解,而NaCl不能;
B.Fe与氯化铁反应生成氯化亚铁;
C.二者均与氨水反应转化为沉淀;
D.氧化铝与NaOH溶液反应,而氧化铁不能.
解答 解:A.加热氯化铵分解生成气体,而NaCl不能,则加热可除杂,故A正确;
B.Fe与氯化铁反应生成氯化亚铁,则加Fe可除杂,故B正确;
C.二者均与氨水反应转化为沉淀,将原物质反应掉,不能除杂,故C错误;
D.氧化铝与NaOH溶液反应,而氧化铁不能,则加氢氧化钠溶液、过滤可除杂,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
16.实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的是( )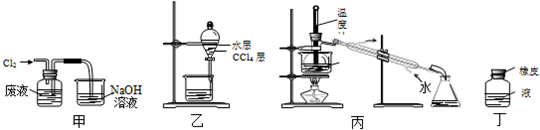

| A. | 用装置甲氧化废液中的溴化氢 | B. | 用装置乙分离CCl4层和水层 | ||
| C. | 用装置丙分离CCl4和液溴 | D. | 用仪器丁长期贮存液溴 |
13.在某恒温密闭容器中,投入一定量的A发生可逆反应 A(s)?B(g)+C(g)△H=-QkJ.mol-1达到平衡.缩小容器体积,重新达到平衡时.以下分析不正确的是( )
| A. | C(g)的浓度与缩小体积前的平衡浓度相等 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 若保持体积不变,向平衡体系中加入少量的A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 molC,达到平衡时吸收热量Q kJ |
20.下列化合物中只含有离子键的是( )
| A. | KOH | B. | H2O | C. | CaCl2 | D. | NH3 |
10.下列措施能减慢化学反应速率的是( )
| A. | 双氧水分解时加入二氧化锰 | B. | 将块状药品研细后在进行反应 | ||
| C. | 用较浓的盐酸代替稀盐酸与锌反应 | D. | 将易腐败的食物储存在冰箱里 |
17.下列关于糖类,油脂,蛋白质,纤维素的说法中,正确的是( )
| A. | 常温下遇碘水均会变蓝色 | |
| B. | 一定条件下,它们都能发生水解反应 | |
| C. | 它们的组成都含有C、H、O、N等元素 | |
| D. | 油脂都是高级脂肪酸的甘油酯,是高热营养素 |
14.在如图所示的原电池中,下列说法正确的是( )
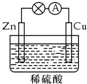

| A. | 负极发生还原反应 | B. | 正极反应为 Cu-2e-═Cu2+ | ||
| C. | 电子由铜片通过导线流向锌片 | D. | 反应一段时间后,溶液的酸性减弱 |