题目内容
15.某同学欲配制符合下列条件的溶液,其中能达到目的是( )①只含0.1mol Na+、0.2mol Mg2+、0.1mol Cl-和0.1mol NO3-的溶液;
②只含0.1mol NH4+,0.1mol Ca2+、0.1mol CO32-和0.1mol Cl-的溶液;
③常温时,0.5mol•L-1的Ca(OH)2溶液;
④常温时,pH=3的含有Cu2+、H+、SO42-的溶液.
| A. | ①④ | B. | ④ | C. | ②③ | D. | ③④ |
分析 ①溶液中满足电中性,根据电荷守恒判断;
②钙离子与碳酸根离子反应生成碳酸钙沉淀;
③氢氧化钙为微溶物,其溶解度较小,室温下无法配制0.5mol/L的氢氧化钙溶液;
④pH=3的溶液中氢离子浓度为0.001mol/L,三种离子之间不反应,可以共存.
解答 解:①溶液要呈电中性,即阳离子所带的正电荷数要与阴离子所带的负电荷数相等,而只含0.1mol Na+、0.2mol Mg2+、0.1mol Cl-和0.1mol NO3-的溶液中,阳离子所带的正电荷的物质的量为:n=0.1mol+0.2mol×2=0.5mol,阴离子所带的负电荷的物质的量为:n=0.1mol+0.1mol=0.2mol,溶液不呈电中性,故①错误;
②在溶液中,Ca2+和CO32-不能共存,无法配制该溶液,故②错误;
③1L 0.5mol•L-1的Ca(OH)2溶液中含有0.5mol氢氧化钙,氢氧化钙的质量为:74g/mol×0.5mol=37g,1L该溶液的质量约为1000g,则该氢氧化钙溶液的溶解度约为:$\frac{37g}{1000g-37g}×100g$≈3.84g,而氢氧化钙为微溶物,其溶解度小于1g,所以无法配制该浓度的氢氧化钙溶液,故③错误;
④常温时,pH=3的溶液中氢离子浓度为0.001mol/L,Cu2+、H+、SO42-之间不反应,可以大量共存,故④正确;
故选B.
点评 本题考查了离子共存的判断及应用,题目难度中等,明确离子反应发生条件为解答关键,注意明确溶液电中性的含义及应用,③为易错点,需要注意氢氧化钙为微溶物.

练习册系列答案
相关题目
5.出去下列各组物质中的杂质(括号内为杂质),采用方法不正确的是( )
| A. | NaCl(NH4Cl):加热 | B. | FeCl2(FeCl3):铁粉 | ||
| C. | AlCl3(MgCl2):加氨水 | D. | Fe2O3(Al2O3):加氢氧化钠溶液 |
6.下列说法正确的是( )
| A. | 热稳定性:H2O>H2S>HF | |
| B. | 微粒X2-和Y2+的核外电子排布相同,离子半径:X2-<Y2+ | |
| C. | 第3周期金属都能与氯气发生化合反应 | |
| D. | 第IVA族元素的氧化物都能与NaOH溶液反应生成盐和水 |
7.在除去混在二氧化碳气体中少量硫化氢气体的洗气瓶中,应盛放的液体是( )
| A. | 氢氧化钠溶液 | B. | 水 | C. | 亚硫酸 | D. | 硫酸铜 |
4.下列物质见光不会分解的是( )
| A. | HClO | B. | NH4Cl | C. | HNO3 | D. | AgNO3 |
4.下列化学实验中的第一步操作错误的是( )
| A. | 检查装置的气密性--制取气体、验证气体的性质等与气体有关的实验操作 | |
| B. | 检查是否漏水--滴定管、容量瓶、分液漏斗等的使用 | |
| C. | 验纯--点燃可燃性气体 | |
| D. | 湿润--用石蕊试纸、碘化钾淀粉试纸和pH 试纸检验或验证某些气体 |

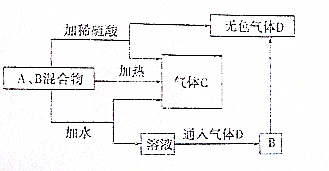 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题: