题目内容
10.下面是你熟悉的物质:O2、CO2、NaBr、H2SO4、Na2CO3、K2S、NaHSO4.(1)这些物质中,只含共价键的是O2、CO2、H2SO4,只含离子键的是NaBr、K2S,既含共价键又含离子键的是Na2CO3、NaHSO4;
(2)将Na2CO3溶于水,破坏了Na2CO3中的离子键,写出其电离方程式Na2CO3=2Na++CO32-.
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,氧气分子中O原子以共用电子对形成共价键,硫化钾中通过得到电子形成离子键,据此分析解答.
解答 解:O2共价键形成的单质分子;CO2共价键形成的化合物分子;NaBr只含离子键;H2SO4只含共价键;Na2CO3既含共价键又含离子键;K2S只含离子键;NaHSO4既含共价键又含离子键;
(1)这些物质中,只含共价键的是O2、CO2、H2SO4;只含离子键的是NaBr、K2S;既含共价键又含离子键的是Na2CO3、NaHSO4;故答案为:O2、CO2、H2SO4;NaBr、K2S;Na2CO3、NaHSO4;
(2)碳酸钠是强电解质,溶于水,破坏了离子键,在水溶液里完全电离,其电离方程式为Na2CO3=2Na++CO32-,故答案为:离子;Na2CO3=2Na++CO32-.
点评 本题考查化学键、电离方程式的书写,侧重考查基本概念,注意离子键和共价键的区别,比较容易.

练习册系列答案
相关题目
20.下列叙述正确的是( )
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| D. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 |
18.设NA 为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 25℃,1L pH=1的硫酸溶液中含有H+的数为0.2NA | |
| B. | 标准状况下,11.2L NO与11.2L O2混合所含分子数为0.75NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO3 2-)=1mol/L,则Na+个数为2NA | |
| D. | 电镀铜,阳极减少32g,则电路中转移的电子数为NA |
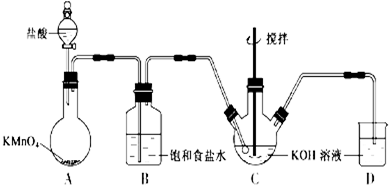
7.下列各装置能达到实验目的是( )


| A. | 用图1所示装置制取氨气 | |
| B. | 用图2所示装置量取20.0ml的H2SO4待测液放入锥形瓶中 | |
| C. | 用图3所示装置用CaC2和饱和食盐水反应制取C2H2 | |
| D. | 用图4所示装置可证明乙醇发生消去反应生成了乙烯 |
4.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | 0.01mol.L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | O.lmol.LNaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量NH4Cl和 NaCl 的混合溶液:c(NH4+)+c(NH3.H20)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+2c(H2CO3)=(10-2-10-12)mol/L |
5.出去下列各组物质中的杂质(括号内为杂质),采用方法不正确的是( )
| A. | NaCl(NH4Cl):加热 | B. | FeCl2(FeCl3):铁粉 | ||
| C. | AlCl3(MgCl2):加氨水 | D. | Fe2O3(Al2O3):加氢氧化钠溶液 |

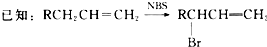
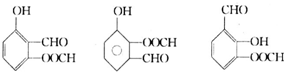 .
. .
.