题目内容
14.有机物A分子组成为C4H9Br,分子中有一个甲基支链,在一定条件下A发生如下转化: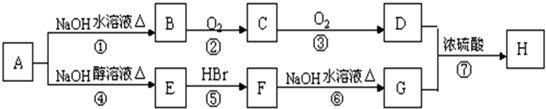
已知:
①不对称烯烃与HBr加成反应时,一般是Br加在含氢较少的碳原子上,如:
R-CH=CH2+HBr$\stackrel{一定条件}{→}$
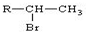 (R为烃基)
(R为烃基)②连接羟基的碳原子上没有氢原子的醇如:
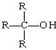 不能发生催化氧化反应.
不能发生催化氧化反应.(1)A的结构简式为(CH3)2CHCH2BrB-H中,与A互为同分异构体的有机物是F(填字母代号)
(2)上述转化中属于取代反应的有①⑥⑦(填序号)
(3)C的结构简式为(CH3)2CHCHO
(4)写出反应④的化学方程式(CH3)2CHCH2Br+NaOH$→_{△}^{醇}$(CH3)2C=CH2+NaBr+H2O.
分析 有机物A分子组成为C4H9Br,分子中有一个甲基支链,A能和NaOH的水溶液发生取代反应生成B,B为醇,B能发生连续氧化反应生成D,D为羧酸,则B中存在-CH2OH结构,所以A为(CH3)2CHCH2Br,B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH.A发生消去反应生成E为(CH3)2C=CH2,E和溴化氢发生加成反应生成F,结合信息①可知,F的结构简式为(CH3)3CBr,F发生水解反应生成G为(CH3)3COH,D与F发生酯化反应生成H为(CH3)2CHCOOC(CH3)3,据此解答.
解答 解:有机物A分子组成为C4H9Br,分子中有一个甲基支链,A能和NaOH的水溶液发生取代反应生成B,B为醇,B能发生连续氧化反应生成D,D为羧酸,则B中存在-CH2OH结构,所以A为(CH3)2CHCH2Br,B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,D为(CH3)2CHCOOH.A发生消去反应生成E为(CH3)2C=CH2,E和溴化氢发生加成反应生成F,结合信息①可知,F的结构简式为(CH3)3CBr,F发生水解反应生成G为(CH3)3COH,D与F发生酯化反应生成H为(CH3)2CHCOOC(CH3)3.
(1)由上述分析可知,A的结构简式为(CH3)2CHCH2Br,B-H中,有机物F为(CH3)3CBr,与A互为同分异构体,故答案为:(CH3)2CHCH2Br;F;
(2)上述转化中②③属于氧化反应,④属于消去反应,⑤属于加成反应,①⑥⑦属于取代反应,故答案为:①⑥⑦;
(3)由上述分析可知,C的结构简式为:(CH3)2CHCHO,故答案为:(CH3)2CHCHO;
(4)反应④的化学方程式为:(CH3)2CHCH2Br+NaOH$→_{△}^{醇}$(CH3)2C=CH2+NaBr+H2O,
故答案为:(CH3)2CHCH2Br+NaOH$→_{△}^{醇}$(CH3)2C=CH2+NaBr+H2O.
点评 本题考查了有机物的推断,关键综合分析确定A的结构简式,再结合转化关系推断,需要学生熟练掌握官能团的性质与转化,难度中等.


| A. | 乙醇发生了还原反应 | B. | 反应中有红黑颜色交替变化的现象 | ||
| C. | 铜是此反应的催化剂 | D. | 生成物是乙醛 |
| A. | ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的电负性随原子序数增大而递增的是④ | |
| B. | 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4对应的第一电离能最大的是④ | |
| C. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素在第三周期第 IIA族 | |
| D. | 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22 s22p63s23p4半径最大的是① |
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)当升高温度时,K值变大,向各弱酸溶液中滴加少量NaOH溶液,K值不变(以上选填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系在相同条件下K值越大,电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②在过量的氯水中滴入少量的碳酸钠溶液2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
| A. | 常温常压下,28gN2含有的原子数为2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-数为3NA | |
| C. | 标准情况下,2.24LCCl4含有的分子数NA | |
| D. | 常温常压下,22.4LCl2与足量铁充分反应,转移电子数为2NA |
| A. | 油脂 | B. | 塑料 | C. | 纤维素 | D. | 淀粉 |
 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.

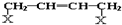

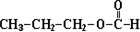 和
和 

 _
_
 .
. .
.