题目内容
2. 能源与资源是现代社会发展的重要支柱.
能源与资源是现代社会发展的重要支柱.Ⅰ.化学反应中的能量变化,通常主要表现为热量的变化.
下列反应中,属于放热反应的是C(填序号).
A.Ra(OH)2•8H2O与NH2Cl混合搅拌 B.高温煅烧石灰石 C.铝与盐酸反应
Ⅱ.电能是现代社会应用广泛的能源之一.
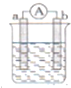
如图是化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
(1)当电极a为Al,电极b为Mg,电解质溶液为稀硫酸时,负极的电极反应式为Al-3e-=Al3+;
当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置能(填“能”或“不能”)形成原电池.若不能,请说明;若能,请说明在两电极上所发生的现象:Ⅱ;
(2)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能.现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,氢氧化钠溶液为电解质溶液.
a极上的电极反应式为O2-4e-+2H2O=4OH-;
Ⅲ.海洋资源的利用具有广阔前景.
(1)无需经过化学变化就能从海水中获得的物质是BD(填序号);
A.Cl2 B.淡水 C.烧碱 D.食盐
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是Cl2+2Br-=Br2+2Cl-;
(3)海带灰中富含以I-形式存在的磷元素,实验室提取I2的途径如下所示:

①烧灼海带至灰烬时,所有的主要仪器名称是坩埚;
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式2H++2I-+H2O2═I2+2H2O.
分析 Ⅰ、根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);
Ⅱ、(1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子;Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,以此来解答;
(2)氢氧燃料电池中氧气在正极反应,在NaOH溶液中生成氢氧根离子;
Ⅲ、(1)从海水制备物质的原理可知,金属单质与非金属单质需要利用化学反应来制取,而食盐可利用蒸发原理,淡水利用蒸馏原理来得到;
(2)氯气具有强氧化性,能和溴离子发生置换反应生成溴,根据框图从氢氧化镁到氯化镁的反应分析;
(3)①灼烧固体时所用的主要仪器名称是坩埚;
②氢离子和过氧化氢将碘离子氧化为单质碘.
解答 解:Ⅰ、A.Ra(OH)2•8H2O与NH2Cl混合搅拌是吸热反应,故A不选;
B.高温煅烧石灰石是吸热反应,故B不选;
C.铝与盐酸反应是放热反应,故C选;
故答案为:C;
Ⅱ、(1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子,电极反应式为Al-3e-=Al3+;Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,所以Al逐渐溶解,正极上水中的氢离子得到电子生成氢气,发生电池反应为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:Al-3e-=Al3+;能;Al电极逐渐溶解,Mg电极产生气泡;
(2)氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,碱性溶液中负极反应为2H2-4e-+4OH-=2H2O,正极反应为O2-4e-+2H2O=4OH-,故答案为:O2-4e-+2H2O=4OH-;
Ⅲ、(1)A、电解饱和氯化钠溶液得到烧碱、氢气、氯气,有新物质生成属于化学变化,故错误;
B、把海水用蒸馏等方法可以得到淡水,故正确;
C、电解饱和氯化钠溶液得到烧碱、氢气、氯气,有新物质生成属于化学变化,故错误;
D、把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故正确;
故答案为:BD;
(2)氯气具有强氧化性,能和溴离子发生置换反应生成溴,离子方程式为:Cl2+2Br-=Br2+2Cl-,故答案为:Cl2+2Br-=Br2+2Cl-;
(3)①灼烧固体时所用的主要仪器名称是坩埚,故答案为:坩埚;
②加入氢离子和过氧化氢起的作用为氧化剂,将碘离子转化为单质碘,离子方程式为2H++2I-+H2O2═I2+2H2O,故答案为:2H++2I-+H2O2═I2+2H2O.
点评 本题考查了常见的放热反应、原电池原理和电极反应式的书写以及海水资源的综合运用,根据化学反应的概念及流程图中物质的性质来分析解答,知道流程图中每一步的反应,会书写相应的化学方程式,题目难度不大.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 含1mol HCl 500mL | B. | 含36.5g HCl 500mL | ||
| C. | 2mol•L-1 HCl 500mL | D. | 2mol•L-1 H2SO4 250mL |
实验内容:铜与硝酸反应有关问题的探讨.
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,玻璃丝,酒精灯,试管,夹持器械,火柴.实验记录如下.
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是[Cu(H2O)4]2+(写化学式).
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是[Cu(H2O)4-x(NO3)x](2-x)(1<x<4).
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因可能是还原产物NO2溶入其中引起的,设计两种不同的简单的实验方法证明你的解释:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热(或方案③用水稀释).
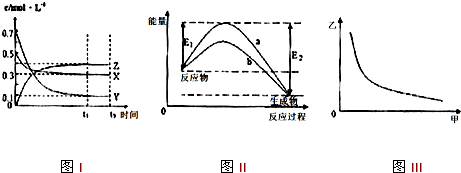
| A. | 该反应的化学方程式为X(g)+3Y(g)?2Z(g) | |
| B. | 图Ⅲ中甲表示压强,则纵坐标可表示混合气体中Z的含量或者混合气体的平均摩尔质量 | |
| C. | 若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图Ⅱ中曲线可表示有无催化剂的能量变化曲线 |
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 2NA个HCl分子与44.8LH2和Cl2的混合气体所含的原子数目均为4NA | |
| C. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| D. | 常温常压下,1mol氦气含有核外电子数为4NA |
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2加热_CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO催化剂_5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.

 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.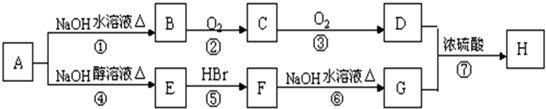
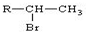 (R为烃基)
(R为烃基)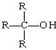 不能发生催化氧化反应.
不能发生催化氧化反应.