题目内容
3.NA表示阿伏伽德罗常数的值,下列说法中正确的是( )| A. | 常温常压下,28gN2含有的原子数为2NA | |
| B. | 1mol•L-1AlCl3溶液中含有的Cl-数为3NA | |
| C. | 标准情况下,2.24LCCl4含有的分子数NA | |
| D. | 常温常压下,22.4LCl2与足量铁充分反应,转移电子数为2NA |
分析 A.根据n=$\frac{m}{M}$计算出氮气的物质的量,再计算出含有氮原子的数目;
B.缺少溶液体积,无法计算溶液中氯离子的数目;
C.标准状况下,四氯化碳为液体,不是气体;
D.常温常压下,不能使用标况下的气体摩尔体积计算氯气的物质的量.
解答 解:A.28g氮气的物质的量为:$\frac{28g}{28g/mol}$=1mol,1mol氮气分子中含有2mol氮原子,含有的原子数为2NA,故A正确;
B.没有告诉1mol•L-1AlCl3溶液的体积,无法计算溶液中含有氯离子的物质的量及数目,故B错误;
C.标况下四氯化碳不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.不是标况下,不能使用标况下的气体摩尔体积计算22.4L氯气的物质的量,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,试题侧重考查标况下气体摩尔体积的使用条件,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件:标况下、气体.

练习册系列答案
相关题目
13.以下素材是某课外实验小组的实验记录,请根据实验记录回答有关问题.
实验内容:铜与硝酸反应有关问题的探讨.
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,玻璃丝,酒精灯,试管,夹持器械,火柴.实验记录如下.
已知:Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂分子[Cu(NH3)4]2+,NH3分子可以换成气体分子或离子.
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是[Cu(H2O)4]2+(写化学式).
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是[Cu(H2O)4-x(NO3)x](2-x)(1<x<4).
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因可能是还原产物NO2溶入其中引起的,设计两种不同的简单的实验方法证明你的解释:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热(或方案③用水稀释).
实验内容:铜与硝酸反应有关问题的探讨.
实验器材:电线细铜丝,1mol•L-1HNO3,14mol•L-1HNO3,碱石灰,Cu(NO3)2晶体,玻璃丝,酒精灯,试管,夹持器械,火柴.实验记录如下.
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
请回答:
(1)稀硝酸与铜丝反应后,所得溶液呈天蓝色的化学粒子符号是[Cu(H2O)4]2+(写化学式).
(2)使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是[Cu(H2O)4-x(NO3)x](2-x)(1<x<4).
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因可能是还原产物NO2溶入其中引起的,设计两种不同的简单的实验方法证明你的解释:方案①向饱和的硝酸铜溶液中通入大量的NO2气体;方案②将浓硝酸与铜丝反应后的溶液加热(或方案③用水稀释).
11.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 2NA个HCl分子与44.8LH2和Cl2的混合气体所含的原子数目均为4NA | |
| C. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| D. | 常温常压下,1mol氦气含有核外电子数为4NA |
12.氮元素的单质和常见的化合物在工、农业生产中用途广泛.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
现将空气深度冷却液化,然后缓慢升温,则最先分离出来的气体是N2.
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.
(1)工业上利用分离空气的方法得到氮气.空气各主要成分的沸点如下:
| N2 | O2 | Ar | CO2 |
| -196°C | -183°C | -186°C | -78°C |
(2)雷雨时空气中的N2转化为NO,生成物NO是无色的气体,难(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应.NO2与水反应的化学方程式为3NO2+H2O=2HNO3+NO.
(3)实验室可用固体NH4Cl与固体Ca(OH)2加热反应制取氨气.
①制取氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;加热\;}}{\;}$CaCl2+2H2O+2NH3↑;
②要制取标准状况下4.48L的氨气,至少需要称取固体NH4Cl的质量为10.7g.
(4)已知:4NH3+6NO$\frac{\underline{\;催化剂\;}}{\;}$5N2+6H2O.化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.

若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体,通过一定体积滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同).
①NH3与稀硫酸溶液反应的离子方程式为NH3+H+=NH4+;;
②为了比较不同催化剂的催化性能,需要测量并记录的数据是溶液显色所需时间.
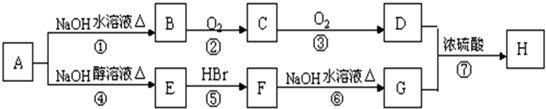
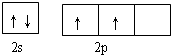
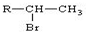 (R为烃基)
(R为烃基) 不能发生催化氧化反应.
不能发生催化氧化反应. .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和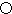 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.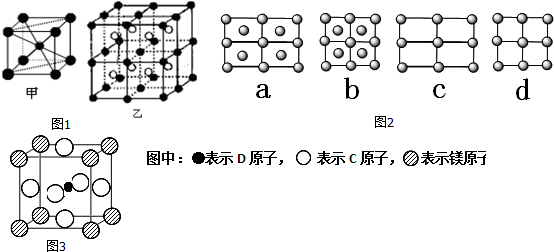
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个. ;
; ;
; (写出名称):苯甲醇
(写出名称):苯甲醇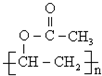 (写出单体的结构简式)CH3COOCH=CH2
(写出单体的结构简式)CH3COOCH=CH2 (写出单体的结构简式)
(写出单体的结构简式) 、HO-CH2-CH2-CH2-CH2-OH.
、HO-CH2-CH2-CH2-CH2-OH.
 .
.