题目内容
6.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是几种常见弱酸的电离平衡常数(25℃).| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| HClO | HClO?ClO-+H+ | 2.95×10-8 |
| H2S | H2S?H++HS- HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++CO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
(1)当升高温度时,K值变大,向各弱酸溶液中滴加少量NaOH溶液,K值不变(以上选填“变大”“变小”或“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系在相同条件下K值越大,电离出的氢离子浓度越大,所以酸性越强.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看做是酸,其中酸性最强的是H3PO4,最弱的是HPO42-.
(4)同一多元弱酸的K1、K2、K3之间存在着数量上的规律,此规律K1:K2:K3≈1:10-5:10-10,产生此规律的原因是上一级电离产生的H+对下一级电离有抑制作用.
(5)请根据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通到过量的碳酸钠溶液中Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②在过量的氯水中滴入少量的碳酸钠溶液2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
分析 (1)弱电解质的电离是吸热反应,升高温度促进电离,根据反应物和生成物浓度的变化确定K的变化,电离平衡常数只与温度有关,与溶液是酸碱性无关;
(2)K值越大,酸的电离程度越大;
(3)电离平衡常数越大的酸性越强,越小的酸性越弱;
(4)产生相同离子微粒间相互有抑制作用;
(5)①盐酸的酸性大于碳酸,碳酸的酸性大于次氯酸,次氯酸的酸性大于碳酸氢根离子,所以氯气和过量的碳酸钠反应反应的离子方程式为:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②盐酸的酸性大于碳酸,碳酸的酸性大量次氯酸,所以过量的氯水和碳酸钠溶液反应的离子方程式为:2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
解答 解:(1)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,则生成物浓度增大反应物浓度减小,所以K值变大,温度不变,电离平衡常数不变,与溶液的酸碱性无关,所以K不变,故答案为:变大;不变;
(2)K值越大,酸的电离程度越大,则溶液中氢原子浓度比氢氧根离子浓度更大,所以溶液的酸性越强,
故答案为:在相同条件下K值越大,电离出的氢离子浓度越大,所以酸性越强;
(3)电离平衡常数越大的酸性越强,越小的酸性越弱,根据表格知,酸性增强的是H3PO4,最弱的是 HPO42-,故答案为:H3PO4;HPO42-;
(4)多元弱酸分步电离,第一步电离程度最大,第二步、第三步依次减小,原因是上一级电离产生的H+对下一级电离有抑制作用,故答案为:上一级电离产生的H+对下一级电离有抑制作用;
(5)①盐酸的酸性大于碳酸,碳酸的酸性大于次氯酸,次氯酸的酸性大于碳酸氢根离子,所以氯气和过量的碳酸钠反应反应的离子方程式为:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-,
故答案为:Cl2+H2O+2CO32-=2HCO3-+Cl-+ClO-;
②盐酸的酸性大于碳酸,碳酸的酸性大量次氯酸,所以过量的氯水和碳酸钠溶液反应的离子方程式为:2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO,故答案为:2Cl2+H2O+CO32-=CO2↑+2Cl-+2HClO.
点评 本题考查了弱电解质的电离,难度不大,知道酸的电离程度越小,其酸性越弱,则其酸根离子的水解程度越大.

| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |
| A. | 红色 | B. | 紫色 | ||
| C. | 蓝色 | D. | 视溶液的酸碱性待定H2 |
| A. | 等物质的量的N2和CO所含分子数均为NA | |
| B. | 2NA个HCl分子与44.8LH2和Cl2的混合气体所含的原子数目均为4NA | |
| C. | 32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA | |
| D. | 常温常压下,1mol氦气含有核外电子数为4NA |
| A. | CH4O | B. | C2H4O | C. | C2H6O | D. | C2H6O2 |
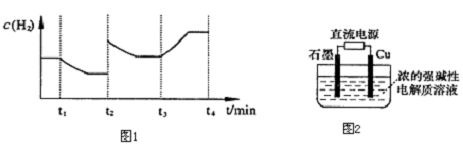
 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.
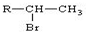 (R为烃基)
(R为烃基)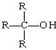 不能发生催化氧化反应.
不能发生催化氧化反应. .A的一种晶体的晶胞如图1甲,乙图中
.A的一种晶体的晶胞如图1甲,乙图中 和
和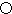 表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
表示的是同种原子,即乙是8个甲无隙并置的结果,若按甲图中虚线方向切乙,得到图2的a~d,图中正确的是a.
 . 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个
. 据报道,只含镁、C和D三种元素的晶体竟然具有超导性.该晶体的结构(如图3示)可看作由镁原子和C原子在一起进行面心立方密堆积,该晶体的化学式为MgCNi3.晶体中每个 原子周围距离最近的
原子周围距离最近的 原子有12个.
原子有12个.