题目内容
A、B、C、D是短周期的四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。试回答:
(1)A原子的电子式为 ,B元素能形成的两种同素异形体的物质的化学式为 ,C元素的离子结构示意图为 。
(2)化合物E中所含有的化学键是 ,它属于 化合物。
(3)写出A、B两元素形成的化合物与E反应的化学方程式: 。
(4)写出D的最高价氧化物的水化物和A单质反应的化学方程式: 。
此反应中氧化产物与还原产物的物质的量之比为 。
(1)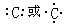 ,O2 O3,
,O2 O3, 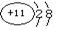
(2)共价键、离子键,(只写1个不给分);离子化合物
(3)2Na2O2+CO2=2Na2CO3+O2
(4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 1:2
CO2↑+2SO2↑+2H2O 1:2
解析试题分析:A、B、C、D是短周期的四种元素,原子序数依次增大,A原子的最外层上有4个电子,则A为碳;A原子的最外层上有4个电子,说明A是ⅣA元素,又因为A的原子序数是四种元素中序数最小的,所以A只能C元素。B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,能生成一种淡黄色的固体E,可推得B为氧,C为钠,E为过氧化钠。D的L层电子数等于K、M两个电子层上的电子数之和。因此D是S元素。(1)碳原子的电子式为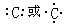 ,B元素能形成的两种同素异形体的物质的化学式为O2 O3, C元素的离子结构示意图为
,B元素能形成的两种同素异形体的物质的化学式为O2 O3, C元素的离子结构示意图为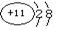 。 (2)过氧化钠中含有的化学键是 共价键、离子键,它属于离子化合物。(3)反应的化学方程式:2Na2O2+CO2=2Na2CO3+O2 。(4)碳和浓硫酸化学方程式:C+2H2SO4(浓)
。 (2)过氧化钠中含有的化学键是 共价键、离子键,它属于离子化合物。(3)反应的化学方程式:2Na2O2+CO2=2Na2CO3+O2 。(4)碳和浓硫酸化学方程式:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O 。此反应中氧化产物是二氧化碳与还原产物二氧化硫的物质的量之比为1:2。
CO2↑+2SO2↑+2H2O 。此反应中氧化产物是二氧化碳与还原产物二氧化硫的物质的量之比为1:2。
考点:本题考查了根据元素周期律对元素的推导。

短周期元素X、Y、Z、L、M、Q的原子半径和主要化合价见下表
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.077 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +4、-4 | -2 |
就以上6种元素,用化学用语回答下列问题
(1)同主族的元素是 ,
(2)写出同周期元素间形成的常温下是有毒气体化合物的分子式为 ,
(3)写出不同周期的元素间形成的常温下为液体且难溶于水的任意一种化合物的电子式 。
(4)等质量的X、Y的单质与足量盐酸反应,生成H2的物质的量之比为
(5)写出由表中元素形成的物质间发生常见的置换反应的化学方程式
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相 关 信 息 |
| X | X最高价氧化物的水化物与气态氢化物可以形成一种盐 |
| Y | 单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z | Z的一种核素质量数为27,中子数为14 |
| W | 最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第__________周期第_________族;Z的原子半径比Y的________, X的第一电离能比Y的________(填“大”或“小”)。
(2)W基态原子的核外电子排布式为____ ____,XH3分子的沸点较高,请解释其原因____ 。
(3)X的氢化物(X2H4)的制备方法之一是将NaClO溶液和XH3反应制得,试写出该反应的离子方程式 。
(4)已知下列数据:4W(s)+ O2(g) = 2W2O(s) △H =" -337.2" KJ/mol 2W(s)+ O2(g) = 2WO(s) △H =" -314.6" KJ/mol;由W2O和O2反应生成WO的热化学方程式是 。
现有部分前36号元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X | 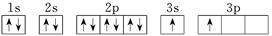 |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是____________________________________。
R原子的结构示意图是 。
(2)S元素的最常见化合价为________,原因是________________________________________。
(3)T元素原子的价电子构型为________。
(4)X的电子排布图违背了____________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:_________________________________。
a、b、c、d、e、f、g为七种由短期周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;c与f反应可形成两个g分子。试写出:
(1)a粒子的核外电子排布式______________________________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱为:________>________ (用化学式表示)。
(3)d溶于水的电离方程式__________________________________________。
(4)c粒子是__________,f粒子是__________(用化学式表示)。
(5)g粒子的共价键数是_____而不是更多,说明共价键具有 性。
 HCNO + NH3(已配平)。完成下列填空:
HCNO + NH3(已配平)。完成下列填空: 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
