题目内容
现有部分前36号元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
| X | 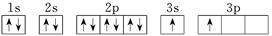 |
(1)R元素的第一电离能要大于其同周期相邻的元素,原因是____________________________________。
R原子的结构示意图是 。
(2)S元素的最常见化合价为________,原因是________________________________________。
(3)T元素原子的价电子构型为________。
(4)X的电子排布图违背了____________。用X单质、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因:_________________________________。
(1)原子的2p轨道半充满,能量低,稳定 (2分)示意图略(1分)
(2)-1(1分) F的电负性最大,只能得电子(2分) (3)3d14s2(1分)
(4)能量最低原理(1分)电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量(2分)
解析试题分析:基态原子的最外层有3个未成对电子,次外层有2个电子,这说明R是第二周期元素,则R是氮元素;单质能与水剧烈反应,所得溶液呈弱酸性,则S是F元素;基态原子3d轨道上有1个电子,则根据构造原理可知,T是21号元素钪元素;X的核外电子数是12个,实验X是Mg元素。
(1)由于氮元素原子的2p轨道半充满,能量低,稳定性强,所以氮元素的第一电离能要大于其同周期相邻的元素。氮元素是第二周期第ⅤA族元素,所以R原子的结构示意图是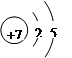 。
。
(2)由于F的电负性最大,属于第ⅦA族元素,只能得到1个电子,所以常见化合价是-1价。
(3)根据构造原理可知钪元素原子的价电子构型为3d14s2。
(4)由于3s能级的能量低于3p能级的能量,所以核外电子首先排满3s,然后在排3p能级。因此根据 可知,电子排布图违背了能量最低原理。由于电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以碱金属盐及碱土金属盐等可以做成焰火。
可知,电子排布图违背了能量最低原理。由于电子从能量较高的轨道跃迁到能量较低的轨道时,以光的形式释放能量,所以碱金属盐及碱土金属盐等可以做成焰火。
考点:考查核外电子排布、原子结构示意图、轨道表达式、电离能以及焰色反应等

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
A、B、C、D、E、 F是周期表中短周期的六种元素,有关性质或结构信息如下表:
| 元素 | 有关性质或结构信息 |
| A | 雷雨天大气中会有A的一种单质生成 |
| B | B离子与A离子电子数相同,且是所在周期中单核离子半径最小的 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D是制造黑火药的一种成分,也可用于杀菌消毒 |
| E | E与D同周期,且在该周期中原子半径最小Ks5u |
| F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
(1)A与C以原子个数比为1:1形成的化合物的电子式为 ,将0.6 mol该化合物投入到100 mL 3 mol/L BE3溶液中的离子方程式为 , 。
(2)F的氢化物是由 (极性或非极性)键形成的 (极性或非极性)分子,写出实验室制备该氢化物的化学方程式 。
(3)下图可用于实验证明D、E的非金属性的强弱。
① 溶液a和b分别为 , (写化学式)。
②溶液a与固体a反应的离子方程式为 。
③非金属性D E(填大于或小于),请从原子结构的角度解释原因 。
根据下列五种元素的第一至第四电离能数据(单位: kJ·mol-1),回答下列各题:
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 496 | 4 562 | 6 912 | 9 543 |
| S | 738 | 1 451 | 7 733 | 10 540 |
| T | 578 | 1 817 | 2 745 | 11 575 |
| U | 420 | 3 100 | 4 400 | 5 900 |
(1)在周期表中,最可能处于同一族的是________。
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:______,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第_____个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是__________________。
 C2(g)=AC2(g) ΔH=-283.0 kJ·mol-1
C2(g)=AC2(g) ΔH=-283.0 kJ·mol-1