题目内容
(11分)(1)现有A、B、C、D、E五种原子序数递增的主族元素,A的原子核中没有中子;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5;C的单质跟盐酸反应,生成C3+和氢气;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构。
① 写出元素符号:A ,D ,E 。
② B、C的最高价氧化物对应水化物相互反应的离子方程式为:
。
③ 写出A2D的电离方程式: , 。
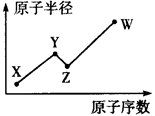
(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质。N P AS ;O S Se分别是VA族、VIA族连续三元素。
①根据元素周期律,预测:酸性强弱 H3AsO4 H3PO4。(用“>”或“<”表示)
② 元素S的最高正价和最低负价的代数和为____________,在一定条件下,S与H2反应有一定限度,请判断:在相同条件下Se与H2反应的限度比S与H2反应限度 。(选填“更大”、“更小”或“相同”)
③将SO2气体通入溴水恰好完全反应后,溶液中存在的离子浓度由大到小的顺序是_________________。
(1)①H S K ②Al(OH)3 + OH-=AlO2- + 2H2O ③H2S  H+ + HS-
H+ + HS-
HS- H+ + S2- (2)①< ②4 ③c(H+)> c(Br-)> c(SO42-)>c(OH-)
H+ + S2- (2)①< ②4 ③c(H+)> c(Br-)> c(SO42-)>c(OH-)
解析试题分析:(1)A的原子核中没有中子,则A为氢元素;B、D元素处于同一周期,D的原子半径较小,B、D的质子数之和为27,质子数之差为5,令B、D质子数分别为x、y,则x+y=27,y-x=5,解得x=11,y=16,故B为钠元素,D为硫元素;C的单质跟足量盐酸反应,生成C3+和氢气,则C为铝元素;E和D能形成E2D型离子化合物,且E、D两元素的简单离子具有相同电子层结构,E形成+1价离子,离子核外有18个电子,则E为钾元素。①由分析可知,A为H,D为S,E为K。②B、C的最高价氧化物对应水化物为NaOH、Al(OH)3,氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,二者相互反应的离子方程式为OH-﹢Al(OH)3=AlO2-﹢2H2O;③H2S 的电离方程式为H2S  H+ + HS- HS-
H+ + HS- HS- H+ + S2-;(2)①根据同主族元素性质递变规律:同主族元素最高价氧化物水化物的酸性由上到下逐渐增强知:酸性强弱 H3AsO4 <H3PO4。②S位于VIA族,最高正价为+6价,负价为-2价,代数和为4;根据同主族元素由上到下单质与氢化合越来越难知在相同条件下Se与H2反应的限度比S与H2反应限度更小;③将SO2气体通入溴水恰好完全反应离子方程式为Br2 + SO2 +2H2O=2Br- + 2H+ + SO42-,溶液中存在的离子浓度由大到小的顺序是c(H+)> c(Br-)> c(SO42-)>c(OH-)。
H+ + S2-;(2)①根据同主族元素性质递变规律:同主族元素最高价氧化物水化物的酸性由上到下逐渐增强知:酸性强弱 H3AsO4 <H3PO4。②S位于VIA族,最高正价为+6价,负价为-2价,代数和为4;根据同主族元素由上到下单质与氢化合越来越难知在相同条件下Se与H2反应的限度比S与H2反应限度更小;③将SO2气体通入溴水恰好完全反应离子方程式为Br2 + SO2 +2H2O=2Br- + 2H+ + SO42-,溶液中存在的离子浓度由大到小的顺序是c(H+)> c(Br-)> c(SO42-)>c(OH-)。
考点:考查元素推断及同周期同主族元素性质递变规律、离子方程式的书写

X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
| A.2X2Q(g) + O2(g) =" 2Q(s)" + 2X2O(g)△H=" -2a" kJ·mol-1 |
| B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" +a" kJ·mol-1 |
| C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l)△H=" -2a" kJ·mol-1 |
| D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" -a" kJ·mol-1 |
 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。