题目内容
【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
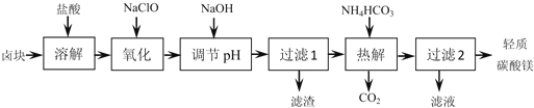
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。
【答案】2Fe2++ClO-+2H+=2Fe3++Cl-+H2O 在保证Mg2+不沉淀的前提下使得Mn2+和Fe3+沉淀完全 若温度太低,反应速率太慢,若太高会导致碳酸氢铵分解 NaCl、NH4Cl 2Mg2++4HCO3-+2H2O=MgCO3·Mg(OH)2·3H2O↓+3CO2↑
【解析】
卤块(主要成分为MgCl2,含Fe2+、Fe3+等杂质离子),工艺流程可知,加入盐酸酸浸溶解,“氧化”目的是将Fe2+氧化物为Fe3+,再通过调节pH值除去,次氯酸根具有强氧化性,将Fe2+氧化物为Fe3+,自身被还原为Cl-,同时生成H2O,过滤得到沉淀为氢氧化铁,滤液加入碳酸氢铵热解生成二氧化碳和轻质碳酸镁[MgCO3Mg(OH)23H2O],过滤得到轻质碳酸镁。
(1)根据工艺流程可知,“氧化”目的是将Fe2+氧化物为Fe3+,再通过调节pH值除去,次氯酸根具有强氧化性,将Fe2+氧化物为Fe3+,自身被还原为Cl-,同时生成H2O,反应离子方程式为:ClO-+2H++2Fe2+=2Fe3++Cl-+H2O;
(2)根据各氢氧化物沉淀生成的pH与沉淀完全的pH,结合工艺流程可知,“调节pH”目的是使Fe3+、Mn2+等杂质离子生成氢氧化物沉淀除去,且尽量避免Mg2+转化为沉淀,即在保证Mg2+不沉淀的前提下使得Mn2+和Fe3+沉淀完全;
(3)由工艺流程可知,“热解”操作目的是将Mg2+、HCO3-转化为MgCO3、Mg(OH)2沉淀,温度过高NH4HCO3会分解,温度太低,反应速率较慢;
(4)由工艺流程可知,过滤2操作所得滤液中含有Na+、NH4+、Cl-,则从中能回收的盐类物质为NaCl、NH4Cl;
(5)由工艺流程可知,“热解”操作中Mg2+、HCO3-转化为MgCO3Mg(OH)23H2O沉淀,同时生成CO2,故反应方程式为2Mg2++4HCO3-+2H2O=MgCO3·Mg(OH)2·3H2O↓+3CO2↑。

 优生乐园系列答案
优生乐园系列答案【题目】硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
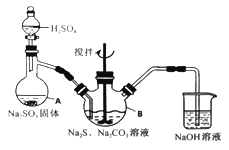
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
……
(1)写出仪器A的名称_______。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH <7,请用离子方程式解释原因_________。
(3)写出三颈烧瓶B中制取Na2S2O3,反应的总化学反应方程式________。
(4)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的步骤为

为减少产品的损失,操作①为趁热过滤,“趁热”的原因是______;操作②是______;操作①是抽滤、洗涤、干燥。
(5)测定产品纯度
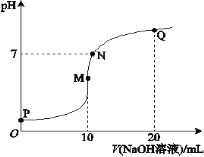
取6.00g产品,配制成100mL溶液。取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.500mol/LI2的标准溶液进行滴定,反应原理为2S2O32-+I2=S4O62-+2I-。相关数据记录如下表所示。
编号 | 1 | 2 | 3 |
溶液的体积/mL | 10.00 | 10.00 | 10.00 |
消耗I2标准溶液的体积/mL | 19.98 | 22.50 | 20.02 |
滴定时,达到滴定终点的现象是___________。产品的纯度为____________。
(6)Na2S2O3常用作脱氧剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________。