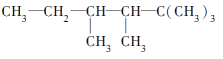题目内容
【题目】有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)( )
A. 0.448LB. 0.672LC. 0.896LD. 0.224L
【答案】B
【解析】
n(H+)=4mol/L![]() 0.01L
0.01L![]() 2+2mol/L
2+2mol/L![]() L=0.10mol n(NO3-)=2mol/L
L=0.10mol n(NO3-)=2mol/L![]() L=0.02 mol
L=0.02 mol
根据反应方程式,酸过量。
设生成气体为nmol
3Cu+ 8H+ + 2NO3-=3Cu2++2NO![]() +4H2O n(H+)=0.10mol
+4H2O n(H+)=0.10mol
2 2
0.02mol n
n=0.02mol
标准状况下气体的体积为0.02 mol ![]() = 0.448L故A正确。B C D均错误。
= 0.448L故A正确。B C D均错误。

练习册系列答案
相关题目
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表。
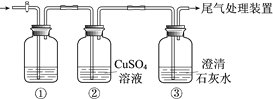
实验 | 操作 | 现象 |
Ⅰ | 向盛有Na2S溶液的①中持续通入CO2至过量 | ②中产生黑色沉淀,溶液的pH降低; ③中产生白色浑浊,该浑浊遇酸冒气泡 |
Ⅱ | 向盛有NaHCO3溶液的①中持续通入H2S气体至过量 | 现象同实验Ⅰ |
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A. ③中白色浑浊是CaCO3
B. ②中溶液pH降低的原因是:H2S+Cu2+ == CuS↓+2H+
C. 实验Ⅰ①中CO2过量发生的反应是:CO2+H2O+ S2== CO32+ H2S
D. 由实验Ⅰ和Ⅱ不能比较H2CO3和H2S酸性的强弱