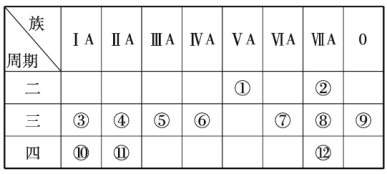
题目内容
【题目】室温下,将0.1 mol·L-1 NaOH溶液逐滴滴入10 mL 0.1 mol·L-1 NH4HSO4溶液中,溶液的pH与NaOH溶液体积关系如图所示:
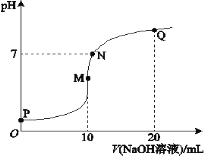
下列关系中,不正确的是
A.M点c(Na+)>c(![]() )
)
B.N点c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -)
-)
C.Q点c(![]() )+c(NH3·H2O)=c(Na+)
)+c(NH3·H2O)=c(Na+)
D.M、N、Q三点中,水的电离程度M>N>Q
【答案】C
【解析】
A.M点溶液显酸性NH4HSO4+NaOH= NaNH4 SO4+H2O ,100mL0.lmol·L-1 NH4HSO4 溶液中滴加0.1mol·L-1NaOH溶液100mL,恰好完全反应,NH4+发生水解,所以显酸性,故A选项正确。
B.N点满足c(NH4+)+c(H+)+c(Na+) =c(OH-)+2 c(SO42-),N点PH=7,故c(H+)= c(OH-),所以上述式子可以写成c(![]() )+c(Na+)=2c(
)+c(Na+)=2c(![]() -),故B选项正确。
-),故B选项正确。
C.Q点溶液中含有硫酸钠,氢氧化钠和氨水故根据物料守恒2c(![]() )+2c(NH3·H2O)=c(Na+)
)+2c(NH3·H2O)=c(Na+)
故C选项错误。
D.因为加酸和碱抑制水的电离,水解促进电离,所以 M、N、Q 三个点中,M点水的电离程度最大,N点PH为7,水解程度居中,Q点有氢氧化钠抑制水的电离,故水的电离程度最小,故D选项正确。
故答案选C。

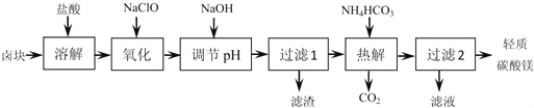
【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。