题目内容
【题目】下列说法正确的是
A.稀释Na2CO3溶液,水解平衡逆向移动,水的电离程度增大
B.0.1 mol·L-1氨水中加入10 mL NaCl溶液,平衡不移动
C.因H2SO4是强酸,CuSO4溶液与H2S不能发生反应
D.用石墨作电极电解硫酸铜溶液的过程中,阳极区H2O![]() H++OH-的电离平衡正向移动
H++OH-的电离平衡正向移动
【答案】D
【解析】
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-,加水稀释,水解平衡正向移动,水的电离程度增大,A错误;
HCO3-+OH-,加水稀释,水解平衡正向移动,水的电离程度增大,A错误;
B.0.1 mol/L氨水中加入10 mL NaCl溶液,相当于加水稀释,NH3H2O的电离平衡正向移动,其电离程度增大,B错误;
C. CuSO4溶液与H2S在溶液中发生反应产生CuS黑色沉淀和H2SO4,C错误;
D.用石墨作电极电解硫酸铜溶液的过程中,阳极区发生反应:OH--4e-=2H2O+O2↑,破坏了附近的水的电离平衡,促使水进一步电离,H2O![]() H++OH-的电离平衡正向移动,D正确;
H++OH-的电离平衡正向移动,D正确;
故合理选项是D。

【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量
【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
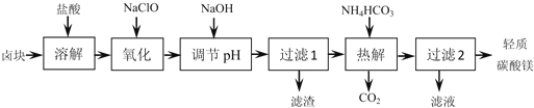
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。