题目内容
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
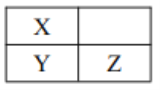
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
【答案】CO2 CaCl2 HClO O2 2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO ![]() HCl===H++Cl- ①⑤
HCl===H++Cl- ①⑤
【解析】
A为黄绿色气体,应为Cl2,与石灰乳反应得到C,C能与气体B反应得到E,而E与石灰水反应也得到E,可推知B为CO2,则E为CaCO3,C为Ca(ClO)2,D为CaCl2,G为HClO,F为HCl,H为O2,据此分析。
A为黄绿色气体,应为Cl2,与石灰乳反应得到C,C能与气体B反应得到E,而E与石灰水反应也得到E,可推知B为CO2,则E为CaCO3,C为Ca(ClO)2,D为CaCl2,G为HClO,F为HCl,H为O2。
(1)B是CO2,D是CaCl2,G是HClO,H是O2;
(2)工业上常利用反应①氯气与石灰乳反应制取漂白粉,该反应的化学方程式:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;
(3)A为氯元素,其原子结构示意图为![]() ;
;
(4)F为HCl,在溶液中的电离方程式为HCl=H++Cl-;
(5)上述反应中属于氧化还原反应的是①2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O氯元素化合价由0价变为+1价和-1价、⑤2HClO![]() 2HCl+ O2↑。
2HCl+ O2↑。

【题目】以高氯冶炼烟灰(主要成分为铜锌的氯化物、氧化物、硫酸盐,少量铁元素和砷元素)为原料,可回收制备Cu和ZnSO4H2O,其主要实验流程如下:
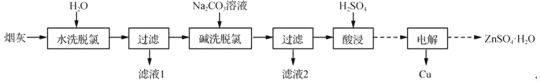
已知:①Fe3+完全沉淀pH为3.2,此时Zn2+、Cu2+未开始沉淀;
②K3[Fe(CN)6]可用于检验Fe2+:3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(深蓝色);
③砷元素进入水体中对环境污染大,可通过沉淀法除去。
(1)两段脱氯均需在85℃条件下进行,适宜的加热方式为_____。
(2)碱洗脱氯时,溶液中Cu2+主要转化为Cu(OH)2和Cu2(OH)2CO3,也会发生副反应得到Cu2(OH)3Cl沉淀并放出气体,该副反应的离子方程式为_____。若用NaOH溶液进行碱洗操作时,浓度不宜过大,通过下表的数据分析其原因是_____。
NaOH溶液浓度对脱氯率和其他元素浸出率的影响
NaOH浓度/molL﹣1 | 脱氯率/% | 元素浸出率/% | ||
Cl | Zn | Cu | As | |
1.0 | 51.20 | 0.51 | 0.04 | 0.00 |
2.0 | 80.25 | 0.89 | 0.06 | 58.87 |
3.0 | 86.58 | 7.39 | 0.26 | 78.22 |
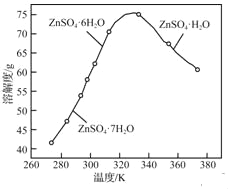
(3)ZnSO4的溶解度曲线如下图所示。“电解”后,从溶液中回收ZnSO4H2O的实验、操作为_____。
(4)滤液1和滤液2中含一定量的Cu2+、Zn2+.为提高原料利用率,可采取的措施有:将滤液1和滤液2混合,回收铜锌沉淀物;循环使用电解过程产生的_____(填化学式)。
(5)已知H3AsO3的还原性强于Fe2+,Ksp(FeAsO3)>Ksp(FeAsO4)=5.7×10﹣21.测得酸浸液中杂质铁元素(以Fe2+存在