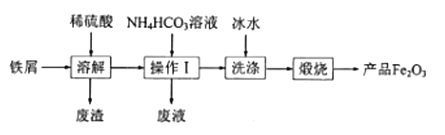
题目内容
【题目】某化学探究小组拟用铜片制取Cu(NO3) 2,并探究其化学性质。
I.他们先把铜粉放在空气中灼烧,再与稀HNO3反应制取硝酸铜。
(1)如果直接用铜屑与稀HNO3反应来制取硝酸铜,可能导致的两个不利因素是______。
(2)实验中铜粉应该放在_____(选填“蒸发皿”、“坩埚”或“烧杯”)中灼烧。欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序分别是___、____、过滤。
II.为了探究Cu(NO3)2的热稳定性,探究小组按下图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)
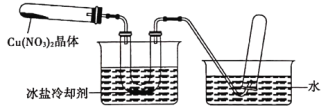
往左试管中放入研细的无水Cu(NO3)2晶体并加热,观察到左试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在右试管中收集到无色气体。
(1)红棕色气体是____。
(2)当导管口不再有气泡冒出时,停止反应,这时在操作上应注意________。
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物除了红棕色气休和黑色固体外,进一步分析、推断,分解产物中一定还含有_____。
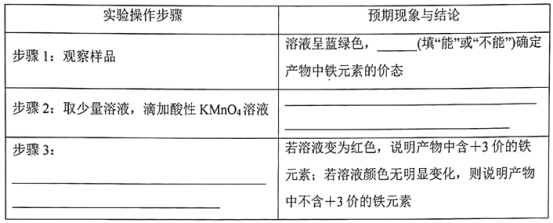
III.为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请在下面表格中补充写出实验操作步骤、预期现象与结论___、___、___。
【答案】生成等物质的量的硝酸铜,消耗硝酸原料多,且产生污染物NO 坩埚 蒸发浓缩 冷却结晶 NO2 先把导气管移出水面,然后熄灭酒精灯火焰 O2 不能 若KMnO4溶液的紫红色褪去或变浅,则说明产物中含+2价铁元素;若KMnO4溶液不褪色或不变浅,则说明产物中不含+2价铁元素 另取少量溶液,滴加KSCN溶液
【解析】
I.(1)比较方案的优劣,一般从三个方面考虑:一是原料是否简单易得,二是操作是否简单,三是否环保;写出反应的化学方程式,然后根据反应原理进行判断两个方案的特点;
(2)灼烧固体用坩埚,硝酸铜溶液中,铜离子存在水解平衡,所以不能直接加热蒸发获得硫酸铜晶体,一般采取蒸发浓缩、冷却结晶的方法;
Ⅱ.(1)NO2是红棕色气体;
(2)注意防止发生倒吸;
(3)根据氧化还原反应中化合价变化判断硝酸铜的分解产物;
Ⅲ. 步骤1:Fe2+的溶液为浅绿色,Fe3+溶液为棕黄色,而该溶液呈蓝绿色,据此分析判断;
步骤2:酸性KMnO4溶液具有氧化性,能够氧化Fe2+,因此若KMnO4溶液的紫红色褪去或变浅说明产物中含+2价的铁元素,否则不含+2价的铁元素;
步骤3:根据“预期现象与结论”可知该操作是为检验溶液中是否含有+3价的铁元素,可知选用的试剂是KSCN溶液。
Ⅰ.(1)生成等物质的量的硝酸铜,假如为1mol,先把铜粉放在空气中灼烧,再与稀HNO3反应制取硝酸铜,消耗2mol硝酸,而Cu直接与稀硝酸发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制取1molCu(NO3)2会消耗![]() mol硝酸,显然消耗的硝酸原料多,并且产生污染性气体NO;
mol硝酸,显然消耗的硝酸原料多,并且产生污染性气体NO;
(2)灼烧固体铜粉用坩埚;由于铜离子在溶液中存在水解平衡,所以从硝酸铜溶液中获得硝酸铜晶体,不能直接蒸发结晶,需要通过蒸发浓缩、冷却结晶,然后过滤的操作方法完成;
Ⅱ.(1)加热Cu(NO3)2晶体产生的红棕色气体是NO2;
(2)为防止发生倒吸现象,应该进行的操作是:先把导气管移出水面,然后熄灭火焰;
(3)探究小组判断Cu(NO3)2的分解属于氧化还原反应,产物中红棕色气体为NO2,黑色固体为CuO,根据化合价变化,硝酸铜中N元素从+5价变为+4价的NO2,化合价降低被还原,则一定存在化合价升高的元素,该元素只能为O元素,反应中O元素被氧化成O2,则分解产物中一定还含有O2,反应的化学方程式:2Cu(NO3)2![]() 2CuO+4NO2↑+O2↑;
2CuO+4NO2↑+O2↑;
Ⅲ.步骤1:Fe2+在溶液中为浅绿色,Fe3+在溶液中为棕黄色,而该溶液呈蓝绿色,因此不能确定产物中铁元素的价态;
步骤2:酸性KMnO4溶液具有氧化性,能够氧化Fe2+变为Fe3+,若KMnO4溶液的紫红色褪去或变浅说明产物中含+2价的铁元素;
步骤3:为检验溶液中是否含有+3价的铁元素,现象为溶液变为红色,因此用的试剂是KSCN溶液。

【题目】轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,以卤块(主要成分为MgCl2,含Fe2+、Fe3+、Mn2+等杂质离子)为原料制备轻质碳酸镁的工艺流程如图:
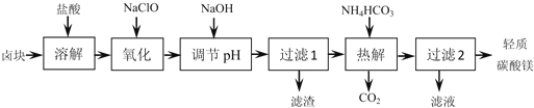
下表中为生成氢氧化物沉淀的pH
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 7.6 | 8.3 | 9.9 |
沉淀完全 | 3.7 | 9.6 | 9.8 | 11.1 |
(1)“氧化”一步中发生反应的离子方程式为______。
(2)“调节pH”一步应调节溶液的pH=9.8,其目的是_______。
(3)“热解”一步温度控制在75℃左右,其原因是_____。
(4)从“过滤2”步骤中得到的滤液中能回收的盐类物质主要有______(填化学式)。
(5)轻质碳酸镁的成分为碱式碳酸镁[MgCO3Mg(OH)23H2O],则“热解”一步发生反应的离子方程式为_______。