题目内容
1.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y是同周期金属性最强的元素,Z的单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )| A. | 原子半径大小顺序:r(W)>r(Y)>r(X) | |
| B. | 非金属性强弱顺序:X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | 化合物Y2X、ZX2、WX3中化学键类型相同 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素;W与X属于同一主族,故W为S元素;Y是同周期金属性最强的元素,处于IA族,原子序数大于氧,故Y为Na;Z单质可制成半导体材料,Z为Si元素.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,X有2个电子层,最外层电子数为6,故X为O元素;W与X属于同一主族,故W为S元素;Y是同周期金属性最强的元素,处于IA族,原子序数大于氧,故Y为Na;Z单质可制成半导体材料,Z为Si元素.
A.同周期自左而右原子半径减小,同主族向上而下原子半径越大,故原子半径Y(Na)>W(S)>X(O),故A错误;
B.同主族自上而下非金属性减弱,同周期随原子序数增大非金属性增强,故非金属性X(O)>W(S)>Z(Si),故B正确;
C.非金属Si<S,故元素S的最高价氧化物对应水化物的酸性比Si的强,故C错误;
D.化合物Na2O为离子化合物,含有离子键,SiO2、SO3属于共价化合物,含有共价键,故D错误,
故选:B.
点评 本题考查结构性质与位置关系、元素周期律等,难度不大,推断元素是解题的关键,注意对基础知识的全面掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列有关叙述中正确的是( )
| A. | 因为s轨道的形式是球形的,所以处于s轨道上的电子做的是圆周运动 | |
| B. | 电子在3px、3py、3ps三个轨道上运动时,能量不同 | |
| C. | 电子云是用来形象的描述电子运动状态的 | |
| D. | H、F、Cl、O的电负性逐渐增大 |
12.除去乙烷中乙烯的方法是( )
| A. | 点燃 | B. | 通过溴水 | C. | 催化加氢 | D. | 通过石灰水 |
16.“生物质能”主要指树木、庄稼、草类等植物直接或间接提供的能量.下列做法既可利用生物质能,又可减少环境污染的是( )
| A. | 秸秆就地焚烧 | B. | 秸秆粉碎还田 | C. | 秸秆生产沼气 | D. | 秸秆造纸 |
11.下列说法正确的是( )
| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 油脂的皂化反应生成脂肪酸和丙醇 | |
| C. | 蛋白质的水解产物都含有醛基和氨基 | |
| D. | 糖类化合物都具有相同的官能团 |
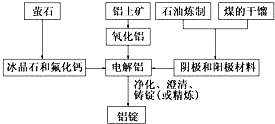 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题: 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2