题目内容
13. 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2(1)上述两个反应能否设计成原电池?(A)不行(B)可以
(2)如果不能,说明其原因(A)不是氧化还原反应,没有发生电子的转移
(3)如果可以,请画出实验装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,写出有关电极反应式.
正极是Cu(或C),正极反应式:2Fe3++2e-=2Fe2+
负极是Fe,负极反应式:Fe-2e-=Fe2+.
分析 (1)原电池反应是自发进行的放热的氧化还原反应;
(2)原电池反应是自发进行的放热的氧化还原反应;
(3)该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反.
解答 解:(1)原电池反应是自发进行的放热的氧化还原反应,(A)中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,(B)中Fe元素化合价发生变化,所以可以设计成原电池,故答案为:(A)不行(B)可以;
(2)(A)不是氧化还原反应,没有发生电子的转移,所以不能设计成原电池,故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)该原电池反应中,Fe元素化合价由0价、+3价变为+2价,所以Fe失电子发生氧化反应,则Fe作负极,不如铁活泼的金属或导电的非金属作正极,氯化铁溶液为电解质溶液,电子从负极沿导线流向正极,电流与电子流向相反,Fe是负极、Cu是正极,电子从Fe沿导线流向Cu,电流从Cu沿导线流向Fe,实验装置图如右图所示: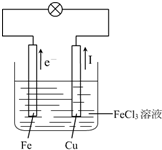
正极上铜离子得电子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+;
负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,
故答案为:Cu(或C);2Fe3++2e-=2Fe2+;Fe;Fe-2e-=Fe2+.
点评 本题考查原电池设计,侧重考查学生知识运用能力及实验方案设计能力,明确原电池原理是解本题关键,会根据电池反应式确定正负极及电解质溶液,题目难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量多 | |
| D. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
1.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y是同周期金属性最强的元素,Z的单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Y)>r(X) | |
| B. | 非金属性强弱顺序:X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | 化合物Y2X、ZX2、WX3中化学键类型相同 |
5.不能由单质直接化合而得到的物质是( )
| A. | CuS | B. | SO2 | C. | FeCl3 | D. | FeS |
2.海洋约占地球表面的71%,具有十分巨大的开发潜力,目前的南海争端威胁到我们国家的核心利益.通过海水资源的开发利用不能得到的是( )
| A. | 石油、天然气 | B. | 铀和重水 | C. | 淡水 | D. | 钠、钾、镁、溴 |

 ,该化合物中含有的化学键是共价键、离子键.
,该化合物中含有的化学键是共价键、离子键.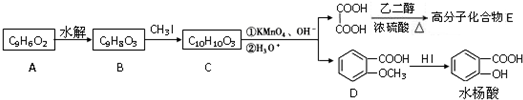
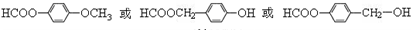 .
.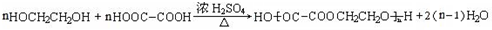 .
.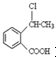 为原料制备
为原料制备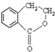 的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$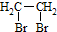 .
.