题目内容
6.把3.86 g Cu-Zn合金粉末放入40 mL 2.0 mol/L的稀硫酸中,完全反应产生气体448 mL(标准状况).试计算:(必须列出计算过程,计算结果保留1位小数)(1)合金中铜的质量分数;
(2)再向上述溶液中滴加稀硝酸,要使金属完全溶解,最少需要2.0 mol/L的硝酸多少毫升?
分析 (1)根据生成气体的体积求出锌的质量,然后求出铜的质量分数;
(2)因为硫酸过量,所以硝酸提供的硝酸根离子完全作用,发生离子反应为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,以此结合方程式计算.
解答 解:(1)由Zn+H2SO4=ZnSO4+H2↑,
65 22.4L
m(Zn) 448 mL×10-3L/ml
所以$\frac{65}{m(Zn)}=\frac{22.4L}{448\\;mL×1{0}^{-3}L/ml}$,解之得:m(Zn)=1.3g,所以铜的质量分数为:1-$\frac{1.3g}{3.86g}×100%$=66.3%,答:合金中铜的质量分数为:66.3%;
(2)铜的物质的量为:$\frac{3.86g-1.3g}{64g/mol}$=0.04mol,滴加稀硝酸,发生反应为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
3 2
0.04mol n(NO3-)
所以n(NO3-)=$\frac{0.08mol}{3}$,所以最少需要2.0 mol/L的硝酸的体积为$\frac{0.08}{3×2}$=13.3ml,答:最少需要2.0 mol/L的硝酸13.3ml.
点评 本题考查物质的量应用于化学方程式的计算,有利于学生对基础知识的巩固,侧重分析能力和计算能力的考查,注意离子方程式的书写及Cu完全反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.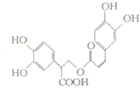 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )| A. | 7:6:1 | B. | 7:6:5 | C. | 6:7:1 | D. | 6:7:5 |
17.化学与生活密切相关,下列有关说法正确的是( )
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “酸可除锈”、“洗涤剂可去油”都是发生了化学变化 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 油脂有油和脂肪之分,在酸性条件下水解生成高级脂肪酸和甘油 |
14.在一定条件下,反应N2+3H2?2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为( )
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.01 mol/(L•min) | D. | v(NH3)=0.17 mol/(L•min) |
1.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y是同周期金属性最强的元素,Z的单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Y)>r(X) | |
| B. | 非金属性强弱顺序:X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | 化合物Y2X、ZX2、WX3中化学键类型相同 |
11.下列现象或事实可用同一化学原理加以说明的是( )
| A. | 氯化铵和碘都可以用加热法进行提纯 | |
| B. | Na、Mg与水反应的溶液中滴入酚酞溶液变红色 | |
| C. | 硫酸亚铁溶液和水玻璃在空气中久置后均会变质 | |
| D. | 氯水和二氧化硫气体均能使品红溶液褪色 |
16.可确认发生了化学平衡移动的是( )
| A. | 改变某平衡体系的温度 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变压强 | |
| C. | 使平衡混合物中各组分的浓度发生变化 | |
| D. | 可逆反应达到平衡后,使用催化剂 |
