题目内容
9.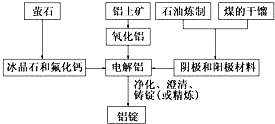 如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:
如图是传统的工业生产金属铝的基本流程图.结合铝生产的流程图回答下列问题:(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是Al2O3(填化学式).石油炼制和煤的干馏产品石墨(或碳)(填物质名称)作电解铝的阴极和阳极材料.
(2)在金属铝的冶炼中加入冰晶石和氟化钙的目的是降低Al2O3的熔融温度,减少熔融电解质的能耗.
(3)在冶炼过程中,阳极材料需要定期进行更换,原因是氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,写出该反应的离子方程式Al2O3+4AlF63-═3Al2OF62-+6F-.若电解的总反应为2Al2O3+3C$\frac{\underline{\;电解\;}}{\;}$3CO2+4Al,则阳极的电极反应式为C+2Al2OF62-+12F--4e-═CO2+4AlF63-.
(4)冰晶石能在碱性溶液中分解,写出冰晶石与足量NaOH溶液反应生成两种钠盐的化学方程式Na3AlF6+4NaOH═6NaF+NaAlO2+2H2O.
(5)已知生产1mol铝消耗的电能为1.8×106J,9g铝制饮料罐可回收能量为0.2kJ,则铝制饮料罐的热回收效率η=0.033%.(热回收效率=回收能量/生产耗能×100%)
分析 传统的工业生产金属铝的基本流程为:萤石主要成分为氟化钙,萤石中加入冰晶石和氟化钙,降低三氧二化铝熔化时所需的温度,电解氧化铝得到铝和氧气,石油炼制和煤的干馏产品中石墨(或碳)可以作为惰性电极电解冶炼铝,电解得到的铝净化、澄清铸锭.
(1)工业上用氧化铝冶炼金属铝,据此确定铝土矿的成分;冶炼铝的电解槽中的阴极和阳极材料均为惰性电极;
(2)冰晶石能溶解Al2O3晶体,被用作助熔剂降低Al2O3的熔点;
(3)氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,依据电荷守恒和原子守恒配平书写离子方程式;
(4)冰晶石能在碱性溶液中分解,冰晶石与足量NaOH溶液反应生成两种钠盐分别为偏铝酸钠和氟化钠,结合原则守恒配平书写化学方程式;
(5)生产9g铝制饮料罐消耗的电能=$\frac{9g}{27g/mol}$×1.8×103KJ,热回收效率=$\frac{回收能量}{生产耗能}$×100%.
解答 解:传统的工业生产金属铝的基本流程为:萤石主要成分为氟化钙,萤石中加入冰晶石和氟化钙,降低三氧二化铝熔化时所需的温度,电解氧化铝得到铝和氧气,石油炼制和煤的干馏产品中石墨(或碳)可以作为惰性电极电解冶炼铝,电解得到的铝净化、澄清铸锭.
(1)工业上用电解熔融氧化铝的方法冶炼铝,冶炼金属铝时用的主要冶炼是铝土矿,说明铝土矿的主要成分是Al2O3,电解法冶炼金属铝需要使用惰性电极,石油炼制和煤的干馏产品中石墨(或碳)可以作为惰性电极电解冶炼铝;
故答案为:Al2O3;石墨(或碳);
(2)Al2O3属于离子晶体,熔点较高,加入冰晶石和氟化钙,熔融的冰晶石和氟化钙能溶解Al2O3晶体,所以其在电解冶炼铝时被用作助熔剂,降低三氧二化铝熔化时所需的温度,在金属铝的冶炼中加入冰晶石和氟化钙的目的是降低Al2O3的熔点,减少熔融电解质的能耗;
故答案为:降低Al2O3的熔点,减少熔融电解质的能耗;
(3)氧化铝溶解并和部分冰晶石发生反应生成Al2OF62-,依据电荷守恒和原子守恒配平书写离子方程式为:Al2O3+4AlF63-═3Al2OF62-+6F-; 若电解的总反应为2Al2O3+3C$\frac{\underline{\;电解\;}}{\;}$3CO2+4Al,电解池中阳极上是元素化合价升高失电子发生氧化反应,则阳极的电极反应式:C+2 Al2OF62-+12F--4e-═CO2+4 AlF63-;
故答案为:Al2O3+4AlF63-═3Al2OF62-+6F-;C+2Al2OF62-+12F--4e-═CO2+4AlF63-;
(4)冰晶石与足量NaOH溶液反应生成两种钠盐分别为偏铝酸钠和氟化钠,结合原则守恒配平书写化学方程式为:Na3AlF6+4NaOH═6NaF+NaAlO2+2H2O;
故答案为:Na3AlF6+4NaOH═6NaF+NaAlO2+2H2O;
(5)已知生产1mol铝消耗的电能为1.8×106J,9g铝制饮料罐可回收能量为0.2kJ,生产9g铝制饮料罐消耗的电能=$\frac{9g}{27g/mol}$×1.8×103KJ,则铝制饮料罐的热回收效率η=$\frac{回收能量}{生产耗能}$×100%=$\frac{0.2KJ}{\frac{9}{27}×1.8×1{0}^{3}KJ}$×100%=0.033%,
故答案为:0.033%.
点评 本题考查化学工艺流程、电解原理等,题目难度中等,理解工艺流程是解题的关键,需要学生基本扎实的据此与运用知识分析解决问题的能力.注意复杂离子方程式和化学方程式的书写方法应用.

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案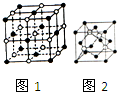 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
| A. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| B. | “酸可除锈”、“洗涤剂可去油”都是发生了化学变化 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 油脂有油和脂肪之分,在酸性条件下水解生成高级脂肪酸和甘油 |
| A. | v(H2)=0.03 mol/(L•min) | B. | v(N2)=0.02 mol/(L•min) | ||
| C. | v(NH3)=0.01 mol/(L•min) | D. | v(NH3)=0.17 mol/(L•min) |
| A. | 原子半径大小顺序:r(W)>r(Y)>r(X) | |
| B. | 非金属性强弱顺序:X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | 化合物Y2X、ZX2、WX3中化学键类型相同 |