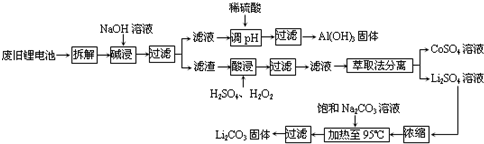
题目内容
11.下列有关叙述中正确的是( )| A. | 因为s轨道的形式是球形的,所以处于s轨道上的电子做的是圆周运动 | |
| B. | 电子在3px、3py、3ps三个轨道上运动时,能量不同 | |
| C. | 电子云是用来形象的描述电子运动状态的 | |
| D. | H、F、Cl、O的电负性逐渐增大 |
分析 A.电子云轮廓图称为原子轨道,S轨道的形状是球形的,表示电子出现概率大小;
B.同一能级中的电子能量相同;
C.电子云就是用小黑点疏密来表示空间各电子出现概率大小的一种图形;
D.电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,同周期元素从左到右元素的电负性依次增大,同主族自上而下电负性减小.
解答 解:A.S轨道的形状是球形的,表示电子出现概率大小,而不表示电子运动轨迹,故A错误;
B.3px、3py、3pz属于同一能级上的电子,其能量相同,故B错误;
C.电子云不是笼罩在原子核外的雨雾,是表示电子出现的几率,用来描述电子运动状态,小黑点的疏密表示电子在原子核外单位体积内出现机会的大小,故C正确;
D.O、F处于同一周期,同周期自左而右电负性增大,故电负性O<F,F、Cl同主族,自上而下电负性减小,故电负性Cl<F,非金属性越强电负性越强,所以H、Cl、O、F的电负性逐渐增大,故D错误;
故选C.
点评 本题考查轨道、电子云、电负性等知识点,易错选项是B,注意同一能级上电子能量相同,明确电子云含义,为易错点,注意元素电负性大小判断技巧,题目难度中等.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
11.化学与生活密切相关,下列说法错误的是( )
| A. | 航天服材质是由碳化硅/陶瓷和碳纤维等复合而成,具有耐高温防寒等性能 | |
| B. | 从海水提取物质不一定都必须通过化学反应才能实现 | |
| C. | 二氧化硅可用于制备太阳能电池板,晶体硅可用于制作光导纤维 | |
| D. | 明矾可用于自来水的净化,氯气可用于自来水的杀菌消毒 |
19.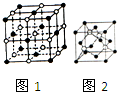 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.
(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
(4)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如图2所示,则A的化学式是CuI,A中铜元素的化合价为+1.
 钠和铜的单质及其化合物在生活实际中有着广泛的应用.
钠和铜的单质及其化合物在生活实际中有着广泛的应用.(1)Cu2+基态的核外电子排布式为1s22s22p63s23p63d9;
(2)NaCl晶体的晶胞结构如图1所示,在NaCl的晶胞中含有的阴离子的个数为4,阳离子的配位数为6;
(3)钠的有关卤化物的熔点间下表,钠的卤化物熔点按NaF、NaCL、NaBr、NaI顺序降低的原因是氟离子、氯离子、溴离子、碘离子的半径变小,所以NaF、NaCL、NaBr、NaI晶体的晶格能变小,所以熔点降低;
| NaF | NaCl | NaBr | NaI | |
| 熔点/℃ | 993 | 801 | 747 | 661 |
6.如图所示的转化关系中,若M为金属单质,则X可能是( )
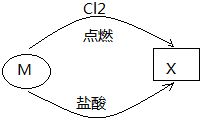

| A. | CuCl2 | B. | FeCl2 | C. | SiCl4 | D. | AlCl3 |
16.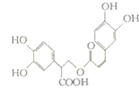 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
 迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )
迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示.则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为( )| A. | 7:6:1 | B. | 7:6:5 | C. | 6:7:1 | D. | 6:7:5 |
3.下列说法正确的是( )
| A. | 需要加热方能发生的反应一定是吸热反应 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 等量H2在O2中完全燃烧生成H2O(g)与生成H2O(l),前者放出的热量多 | |
| D. | 在101 kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 |
1.短周期元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其内层电子总数的3倍,Y是同周期金属性最强的元素,Z的单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 原子半径大小顺序:r(W)>r(Y)>r(X) | |
| B. | 非金属性强弱顺序:X>W>Z | |
| C. | 最高价氧化物对应水化物的酸性:Z>W | |
| D. | 化合物Y2X、ZX2、WX3中化学键类型相同 |