题目内容
12.Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题.(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
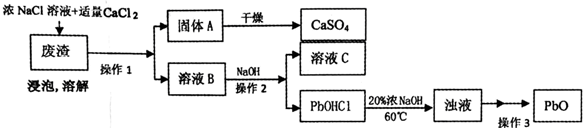
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
分析 (1)二氧化铅和浓盐酸反应生成氯气,同时生成氯化铅和水;
(2)根据题意提供信息,仿照Fe3O4的氧化物形式书写Pb3O4氧化物,把氧化物改写成盐的形式时,要把化合价较低的元素作为阳离子,把化合价较高的元素和氧元素组成酸根;
工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,加入浓氯化钠溶液和适量氯化钙浸泡溶解,增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq),过滤得到A为硫酸钙,滤液B为溶解发生反应得到的溶液,PbC12+2Cl-=PbCl42-,加入氢氧化钠溶液过滤得到PbOHCl沉淀,滤液为氯化钠,在20%的氢氧化钠溶液中加热到60°C,得到浊液过滤得到PbO,
(3)浸泡溶解时采用95℃的高温加快浸泡速率增加氯化铅的溶解度;
(4)溶液C中的溶质为NaCl,在实验室里,将溶质分离出来的方法是蒸发溶剂得到溶质固体,结合蒸发操作选择玻璃仪器;
(5)CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,设原混合物中硫酸钙物质的量为x,硫酸铅物质的量为y,结合硫酸根守恒计算得到.
解答 解:(1)PbO2与浓盐酸共热生成黄绿色气体,说明二者反应生成氯气,同时生成氯化铅和水,反应方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
故答案为:PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Pb在化合物里显+2价或+4价,根据化合价代数和为零的原则写出Pb的两种氧化物形式为:PbO和PbO2,那么Pb3O4的氧化物的表示形式可以写成 2PbO•PbO2,
故答案为:2PbO•PbO2;
(3)浸泡溶解时采用95℃的高温,其主要目的有增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,加快浸泡速率,
故答案为:增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离;加快浸泡速率;
(4)上述分析可知,溶液C中的溶质主要成份是氯化钠,化学式为:NaCl,在实验室里,将溶质分离出来的实验操作为蒸发结晶,需要用到的玻璃仪器有酒精灯、玻璃棒,
故答案为:NaCl;酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,设原混合物中硫酸钙物质的量为x,硫酸铅物质的量为y,列方程组得到:
136x+303y=50
x×(1-5%)+y=$\frac{39.6g}{136g/mol}$=0.29mol
x=0.25mol
y=0.05mol
则废渣中PbSO4的质量分数=$\frac{0.05mol×303g/mol}{50.0g}$×100%=30.2%,
故答案为:30.2%.
点评 本题考查了物质分离提纯、制备方案的分析判断、实验基本操作等知识点,掌握基础是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 为防止水解,FeCl3溶液中加入少量稀硫酸 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
| A. | c(NH4+)相等的(NH4)2SO4溶液,(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) | |
| B. | 0.1 mol/L的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | |
| C. | 0.1mol/L某二元弱酸强碱盐NaHA溶液中:c(Na+)=c(A2-)+c(HA-)+c(H2A) | |
| D. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
| A. | 硅酸钠的水溶液俗称泡花碱,可用作粘合剂和防火材料 | |
| B. | 碘单质在苯中的溶解度较大,可用苯萃取碘水中的碘单质 | |
| C. | 小苏打可用于配制发酵粉,医疗上也可以用作治疗胃酸过多 | |
| D. | 浓硫酸具有强氧化性,不能干燥二氧化硫气体 |
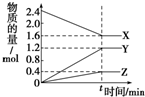 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为2X=3Y+Z | |
| B. | t时,正、逆反应都不再继续进行,反应达到化学平衡 | |
| C. | 若t=4,则0~t的X的化学反应速率为0.1 mol•L-1•min-1 | |
| D. | 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大 |
| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 乙酸和乙酸乙酯互为同分异构体 | |
| C. | 油脂和纤维素都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
| A. | 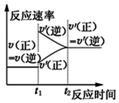 对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| B. | 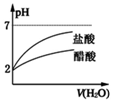 将pH=2的盐酸和醋酸分别加水稀释 | |
| C. | 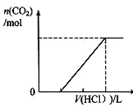 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 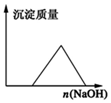 在AlCl3溶液中滴入NaOH溶液至过量 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ① | ② | |||||
| 三 | ③ | ④ | ⑤ | ⑪ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)地壳中含量最多的金属元素是Al.写出元素⑥的最简单氢化物的化学式CH4.
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3.
(4)写出③、④、⑤对应离子氧化性由强到弱的是Al3+>Mg2+>Na+,②、⑦、⑩对应氢化物酸性由强到弱的是HBr>HCl>HF.
(5)写出⑤与氢氧化钠溶液反应的化学方程式:2Al+2NaOH+2H2O═2NaAlO2+3H2↑..