题目内容
7.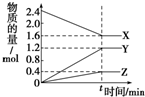 在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是( )| A. | 反应的化学方程式为2X=3Y+Z | |
| B. | t时,正、逆反应都不再继续进行,反应达到化学平衡 | |
| C. | 若t=4,则0~t的X的化学反应速率为0.1 mol•L-1•min-1 | |
| D. | 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大 |
分析 A、根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式,注意该反应为可逆反应,应该用可逆号;
B、根据平衡状态的特征进行回答;
C、根据v=$\frac{△c}{△t}$来计算;
D、根据压强的变化和浓度变化对反应速率的影响关系来判断.
解答 解:A、由图象可以看出,反应中X物质的量减小,Y、Z的物质的量增多,则X为反应物,Y、Z为生成物,且△n(X):△n(Y):△n(Z)=0.8mol:1.2mol:0.4mol=2:3:1,则该反应的化学方程式为:2X?3Y+Z,故A错误;
B、t时,正、逆反应继续进行,反应达到化学平衡,是动态平衡,故B错误;
C、若t=4,则0~t的X的化学反应速率v=$\frac{2.4-1.6}{2×4}$mol•L-1•min-1=0.1mol•L-1•min-1,故C正确;
D、温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率不变,故D错误.
故选C.
点评 本题考查化学平衡图象分析、化学平衡的计算,题目难度中等,注意分析各物质的量的变化曲线,把握化学方程式的判断方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
17.下列物质中,分子内和分子间均可形成氢键的是( )
| A. | NH3 | B. | B | C. | H2O | D. | C2H5OH |
18.下列说法正确的是( )
| A. | 按分散剂可将分散系分为溶液、胶体和浊液 | |
| B. | 元素周期表中含金属元素最多的是 IA族 | |
| C. | Na2O2、CH3F、NH4Cl、Ba(OH)2均为离子化合物 | |
| D. | 漂白粉、福尔马林、钢、王水、氯水均为混合物 |
15.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
2.下列关于著名科学家及其成就的描叙不正确的是( )
| A. | 德国化学家维勒第一次人工合成了尿素,从而揭开了人工合成有机物的序幕 | |
| B. | 中国化学家侯德榜成功发明了侯氏制碱法,打破了外国当时对中国的相关技术封锁 | |
| C. | 英国科学家卢瑟福根据α粒子散射实验提出了“葡萄干面包式”原子结构模型 | |
| D. | 俄国化学家门捷列夫在前人基础上研究提出了元素周期律并列出了第一张元素周期表 |
12.Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题.
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
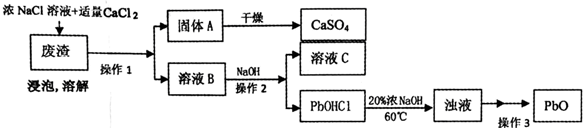
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
(3)浸泡溶解时采用95℃的高温,其主要目的有增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,加快浸泡速率(答两条);
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.

过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
19.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:
Cr2O${\;}_{7}^{2-}$$→_{适量FeSO_{4}溶液}^{①H_{2}SO_{4}溶液}$Cr3+$\stackrel{③调节pH}{→}$Cr(OH)3$\stackrel{③加热}{→}$Cr2O3
有关离子完全沉淀的pH如表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:氯化钠是强电解质,增强溶液导电性.
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:
Cr2O${\;}_{7}^{2-}$$→_{适量FeSO_{4}溶液}^{①H_{2}SO_{4}溶液}$Cr3+$\stackrel{③调节pH}{→}$Cr(OH)3$\stackrel{③加热}{→}$Cr2O3
有关离子完全沉淀的pH如表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:氯化钠是强电解质,增强溶液导电性.
16.下列说法不正确的是( )
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |