题目内容
2.下列有关试剂的保存方法,错误的是( )| A. | 为防止水解,FeCl3溶液中加入少量稀硫酸 | |
| B. | 少量的钠保存在煤油中 | |
| C. | 氢氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
分析 A.加入硫酸,引入杂质离子硫酸根离子;
B.钠性质活泼,能够与空气中水、洋气 反应,密度大于煤油,与煤油不反应;
C.氢氧化钠能够与玻璃中二氧化硅反应生成具有粘性的硅酸钠溶液;
D.氯水中次氯酸不稳定,见光分解;
解答 解:A.为防止水解,FeCl3溶液中加入少量稀盐酸,故A错误;
B.钠保存在煤油中可以隔绝空气中的氧气和水蒸气,故B正确;
C.氢氧化钠能够与玻璃中二氧化硅反应生成具有粘性的硅酸钠溶液,将玻璃塞与玻璃瓶沾到一起,所以氧化钠溶液保存在具有橡皮塞的玻璃试剂瓶中,故C正确;
D.氯水中次氯酸不稳定,见光分解,所以氯水应保存在棕色瓶中,故D正确;
故选:A.
点评 本题考查了化学试剂的保存,明确相关物质的性质是解题关键,题目难度不大,侧重考查学生对基本化学常识掌握熟练程度.

练习册系列答案
相关题目
7.某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448m气体.
下列关于原溶液的说法正确的是( )
| A. | 肯定存在NH4+、Cl-、Br- | |
| B. | SO42-、SO32-至少含有一种 | |
| C. | 是否存在Na+需要通过焰色反应来确定 | |
| D. | 肯定不存在Ba2+、Cu2+、SO32-、CO32- |
13.下图中能验证氯化钠溶液(含酚酞)电解产物的装置是( )
| A. | 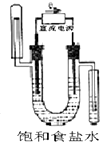 氢氧化钠溶液 | B. | 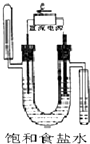 淀粉碘化钾溶液 | C. |  氢氧化钠溶液 | D. | 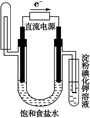 淀粉碘化钾溶液 |
10.下列对于某些离子的检验及结论一定正确的是( )
| A. | 向某溶液中加入稀盐酸产生无色无味的可使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加入稀盐酸,沉淀不消失,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入碳酸钠溶液产生白色沉淀,再加入盐酸,白色沉淀消失,则原溶液中一定含有Ba2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
17.下列物质中,分子内和分子间均可形成氢键的是( )
| A. | NH3 | B. | B | C. | H2O | D. | C2H5OH |
7.一种新型净水剂PAFC(聚合氯化铁铝,化学式可表示为[AlFe(OH)nCl6-n]m,n<5,m<10),广泛用于生活用水的净化和废水的净化.下列有关PAFC的说法正确的是( )
| A. | PAFC用于净化饮用水时,比用相同量的氯化铝或氯化铁对水的pH改变大 | |
| B. | PAFC中铁为+2价 | |
| C. | PAFC可看作一定比例的氯化铝和氯化铁的水解产物 | |
| D. | PAFC在强酸性或强碱性溶液中都能稳定存在 |
14.关于蛋白质的叙述中,正确的是( )
| A. | 天然蛋白质水解的最终产物都是α-氨基酸 | |
| B. | 生物催化剂“酶”是一类特殊的蛋白质,在高温时其活性强 | |
| C. | 蛋白质溶液中的蛋白质分子可透过半透膜 | |
| D. | 通过盐析作用析出的蛋白质难再溶于水 |
11. 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3 |
12.Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题.
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
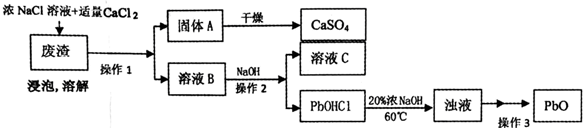
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
(3)浸泡溶解时采用95℃的高温,其主要目的有增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,加快浸泡速率(答两条);
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.

过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).