题目内容
17.下列关于有机物的叙述正确的是( )| A. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| B. | 乙酸和乙酸乙酯互为同分异构体 | |
| C. | 油脂和纤维素都是能发生水解反应的高分子化合物 | |
| D. | 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
分析 A.乙烯与溴水发生加成反应,苯与溴水不反应;
B.乙酸和乙酸乙酯的分子式不同;
C.油脂的相对分子质量在10000以下;
D.甲烷、苯中的H可被取代,乙醇、乙酸的酯化反应和酯类的水解反应均为取代反应.
解答 解:A.乙烯与溴水发生加成反应,苯与溴水不反应,分别为化学变化、物理变化,原理不同,故A错误;
B.乙酸和乙酸乙酯的分子式不同,不是同分异构体,故B错误;
C.油脂的相对分子质量在10000以下,不是高分子,而淀粉为高分子,二者均可发生水解反应,故C错误;
D.甲烷、苯中的H可被取代,乙醇、乙酸的酯化反应和酯类的水解反应均为取代反应,则均可发生取代反应,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意高分子及同分异构体的判断,题目难度不大.

练习册系列答案
相关题目
7.一种新型净水剂PAFC(聚合氯化铁铝,化学式可表示为[AlFe(OH)nCl6-n]m,n<5,m<10),广泛用于生活用水的净化和废水的净化.下列有关PAFC的说法正确的是( )
| A. | PAFC用于净化饮用水时,比用相同量的氯化铝或氯化铁对水的pH改变大 | |
| B. | PAFC中铁为+2价 | |
| C. | PAFC可看作一定比例的氯化铝和氯化铁的水解产物 | |
| D. | PAFC在强酸性或强碱性溶液中都能稳定存在 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ | |
| B. | 强碱性溶液中:NH4+、NO3-、Ba2+、K+ | |
| C. | 澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ | |
| D. | 含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |
5.下列说法正确的是( )
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色 |
12.Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题.
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
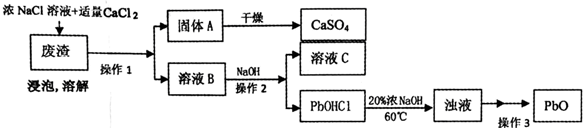
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
(3)浸泡溶解时采用95℃的高温,其主要目的有增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,加快浸泡速率(答两条);
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.

过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
9.同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3
②
③CH3CH2CH3
④HC≡CCH3
⑤
⑥H3CH=CHCH2CH3 .
①CH2=CHCH3
②

③CH3CH2CH3
④HC≡CCH3
⑤

⑥H3CH=CHCH2CH3 .
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
16.随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP[化学式为Cam(PO4)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等于( )
| A. | $\frac{3n+2}{2}$ | B. | $\frac{3n-2}{2}$ | C. | $\frac{2n-2}{3}$ | D. | n+1 |