题目内容
4.在容量瓶的使用方法中,下列操作不正确的是AE(填写标号).A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管加蒸馏水到标线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1~2cm处,用胶头滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
分析 A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大;
C、容量瓶不能用于溶解固体;
D、容量瓶不能稀释浓溶液;
E、摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀.
解答 解:A、使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,故A正确;
B、容量瓶用蒸馏水洗净后,再用待配液润洗,会导致所配溶液浓度偏大,故B错误;
C、由于容量瓶不能受热,而固体溶解时会伴随热效应,故不能用于溶解固体,故C错误;
D、由于容量瓶不能受热,而溶液稀释时会放热,故容量瓶不能用于稀释浓溶液,故D错误;
E、摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故E正确.
故选AE.
点评 本题考查了用容量瓶配制一定物质的量浓度溶液的实验操作和注意事项,难度不大,实验素养的养成在于多动手操作,多动脑思考.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.关于蛋白质的叙述中,正确的是( )
| A. | 天然蛋白质水解的最终产物都是α-氨基酸 | |
| B. | 生物催化剂“酶”是一类特殊的蛋白质,在高温时其活性强 | |
| C. | 蛋白质溶液中的蛋白质分子可透过半透膜 | |
| D. | 通过盐析作用析出的蛋白质难再溶于水 |
15.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
12.Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题.
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
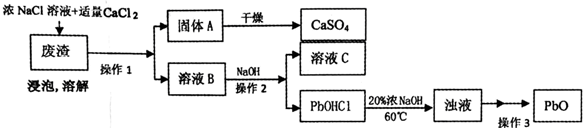
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
(3)浸泡溶解时采用95℃的高温,其主要目的有增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,加快浸泡速率(答两条);
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.

过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
19.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法:
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:
Cr2O${\;}_{7}^{2-}$$→_{适量FeSO_{4}溶液}^{①H_{2}SO_{4}溶液}$Cr3+$\stackrel{③调节pH}{→}$Cr(OH)3$\stackrel{③加热}{→}$Cr2O3
有关离子完全沉淀的pH如表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:氯化钠是强电解质,增强溶液导电性.
I.还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:
Cr2O${\;}_{7}^{2-}$$→_{适量FeSO_{4}溶液}^{①H_{2}SO_{4}溶液}$Cr3+$\stackrel{③调节pH}{→}$Cr(OH)3$\stackrel{③加热}{→}$Cr2O3
有关离子完全沉淀的pH如表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.
则在操作②中可用于调节溶液pH的试剂为:CD(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
II.电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:氯化钠是强电解质,增强溶液导电性.
9.同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3
②
③CH3CH2CH3
④HC≡CCH3
⑤
⑥H3CH=CHCH2CH3 .
①CH2=CHCH3
②

③CH3CH2CH3
④HC≡CCH3
⑤

⑥H3CH=CHCH2CH3 .
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
16.下列说法不正确的是( )
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |

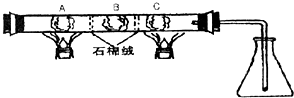 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.