题目内容
20.下列说法不正确的是( )| A. | 硅酸钠的水溶液俗称泡花碱,可用作粘合剂和防火材料 | |
| B. | 碘单质在苯中的溶解度较大,可用苯萃取碘水中的碘单质 | |
| C. | 小苏打可用于配制发酵粉,医疗上也可以用作治疗胃酸过多 | |
| D. | 浓硫酸具有强氧化性,不能干燥二氧化硫气体 |
分析 A.硅酸钠水溶液具有粘性,为矿物胶,硅酸钠熔点高,不易燃烧;
B.依据碘单质易溶于有机物性质解答;
C.碳酸氢钠不稳定加热分解生成二氧化碳,碳酸氢钠能够与盐酸反应;
D.浓硫酸与二氧化硫不反应.
解答 解:A.硅酸钠水溶液具有粘性,为矿物胶,可以做粘合剂,硅酸钠熔点高,不易燃烧,可以做防火材料,故A正确;
B.碘单质易溶于有机溶剂,所以可以用苯萃取碘水中的碘,故B正确;
C.碳酸氢钠不稳定加热分解生成二氧化碳,常用来制备发酵粉,碳酸氢钠能够与盐酸反应,可以用来治疗胃酸过多,故C正确;
D.浓硫酸与二氧化硫不反应,可以用浓硫酸干燥二氧化硫,故D错误;
故选:D.
点评 本题考查了元素化合物知识,侧重考查物质的用途,明确相关物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
10.下列对于某些离子的检验及结论一定正确的是( )
| A. | 向某溶液中加入稀盐酸产生无色无味的可使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32- | |
| B. | 向某溶液中加入氯化钡溶液有白色沉淀产生,再加入稀盐酸,沉淀不消失,则原溶液中一定含有SO42- | |
| C. | 向某溶液中加入碳酸钠溶液产生白色沉淀,再加入盐酸,白色沉淀消失,则原溶液中一定含有Ba2+ | |
| D. | 向某溶液中加入硝酸酸化的硝酸银溶液有白色沉淀生成,则溶液中一定含有Cl- |
11. 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3 |
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ | |
| B. | 强碱性溶液中:NH4+、NO3-、Ba2+、K+ | |
| C. | 澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ | |
| D. | 含大量Fe3+的溶液中:Mg2+、Na+、Cl-、SCN- |
15.设NA 为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
5.下列说法正确的是( )
| A. | 裂化可以提高汽油等轻质油的产量和质量 | |
| B. | 硬脂酸甘油酯皂化反应后得到的主要产品是硬脂酸和甘油 | |
| C. | 乙醇、乙酸、乙酸乙酯分子中均存在-OH | |
| D. | 向2 mL苯中加入1 mL碘的CCl4溶液,振荡后静置,上层呈紫红色 |
12.Pb为第IVA 元素,常见的化合价为+2和+4,其单质和化合物都有着广泛的用途,如制铅蓄电池,化工耐酸设备及防X射线材料等,请回答下列问题.
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
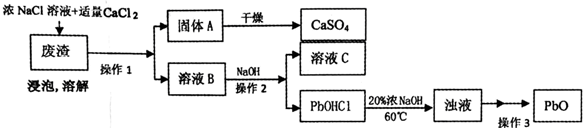
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
(3)浸泡溶解时采用95℃的高温,其主要目的有增大PbCl2在NaCl溶液中的溶解度,便于铅、钙元素的分离,加快浸泡速率(答两条);
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.

过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
9.同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3
②
③CH3CH2CH3
④HC≡CCH3
⑤
⑥H3CH=CHCH2CH3 .
①CH2=CHCH3
②

③CH3CH2CH3
④HC≡CCH3
⑤

⑥H3CH=CHCH2CH3 .
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
10.用铝箔包裹0.1mol金属钠,用针孔扎出一些小孔,将其放入水中充分反应,下列有关叙述正确的是( )
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |