题目内容
1.下列对应的图象符合描述的是( )| A. | 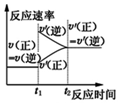 对于达到平衡状态的N2(g)+3H2(g)?2NH3(g)反应,在t1时缩小容器体积,并在t2时又达到平衡 | |
| B. | 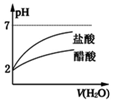 将pH=2的盐酸和醋酸分别加水稀释 | |
| C. | 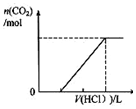 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol•L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 | |
| D. | 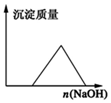 在AlCl3溶液中滴入NaOH溶液至过量 |
分析 A、反应N2(g)+3H2(g)?2NH3(g)是一个反应前后气体体积减小的可逆反应,增大压强正逆反应速率都增大,平衡向正反应方向移动,并再次达到平衡状态;
B、弱电解质溶液中存在电离平衡,加水稀释促进弱电解质电离;
C、先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体;
D、向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,根据物质的溶解性分析解答.
解答 解:A、反应N2(g)+3H2(g)?2NH3(g)是一个反应前后气体体积减小的可逆反应,缩小容器体积,容器内气体的压强增大,导致正逆反应速率都增大,但正反应速率大于逆反应速率,平衡向正反应方向移动,当正逆反应速率相等时,再次达到平衡状态,故A错误;
B、pH=2的盐酸和醋酸中,醋酸是弱电解质氯化氢是强电解质,所以醋酸的浓度大于盐酸,稀释相同的倍数,醋酸中氢离子浓度大于盐酸中氢离子浓度,所以醋酸的pH变化小于盐酸的变化,故B正确;
C、先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体,且等物质的量NaOH、Na2CO3,不产生气体和产生气体消耗的酸应为2:1,与图象不符,故C错误;
D、向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,氢氧化铝是难溶性白色物质,偏铝酸钠是可溶性物质,所以现象是:先产生白色沉淀,最后沉淀溶解,故D错误.
故选B.
点评 本题考查较综合,涉及化学反应的先后顺序与图象、影响反应速率的因素,注重高考考点的考查,题目难度中等

 阅读快车系列答案
阅读快车系列答案 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3 |
(1)PbO2具有强氧化性,在加热时可与浓盐酸反应制Cl2,发生的化学方程式为PbO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$PbCl2+Cl2↑+2H2O;
(2)Fe3O4属于混合氧化物,其组成可表示为FeO•Fe2O3,Pb3O4和Fe3O4一样,也属于混合氧化物,其组成也可表示为2PbO•PbO2;
PbO也是一种重要的物质.工业上生产锌钡白(ZnS•BaSO4)的过程中,会产生含CaSO4、PbSO4的废渣,实验室利用该废渣生产PbO的流程如下.
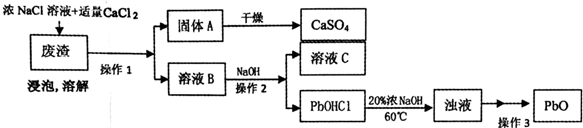
过程中发生的部分反应如下:
浸泡:PbSO4(s)+2Cl-(aq)═PbCl2(s)+SO42-(aq)
溶解:PbC12+2Cl-=PbCl42-;PbCl42-+OH-=PbOHCl↓+3Cl-
有关数据:不同温度和浓度的食盐溶液中PbC12的溶解度(g/L)
NaCl浓度(g/L)温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | 180 | 260 | 300 |
| 13 | 7 | 3 | 1 | 0 | 0 | 0 | 3 | 9 | 13 |
| 50 | 11 | 8 | 4 | 3 | 4 | 5 | 10 | 21 | 35 |
| 100 | 21 | 17 | 11 | 12 | 13 | 15 | 30 | 65 | 95 |
(4)溶液C中的溶质主要成份是NaCl,在实验室里,将溶质分离出来需要用到的玻璃仪器有酒精灯、玻璃棒;
(5)实验时,取用废渣50.0g,实验过程中PbSO4的转化率为100%,CaSO4的损耗率为5%,最后得到干燥的CaSO4固体39.6g,则废渣中PbSO4的质量分数为30.2%(用百分数表示,精确到小数点后一位).
①CH2=CHCH3
②
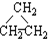
③CH3CH2CH3
④HC≡CCH3
⑤
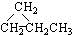
⑥H3CH=CHCH2CH3 .
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |
| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |