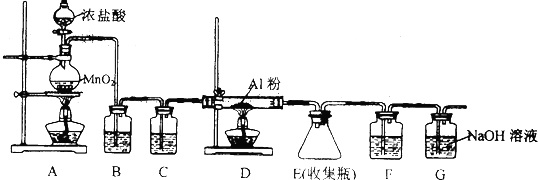
题目内容
12.下列化学用语正确的是( )| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: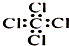 | D. | 2-乙基-1,3-丁二烯分子的键线式: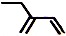 |
分析 A.乙炔的结构简式中碳碳三键不能省略;
B.比例模型能够体现出原子体积的相对大小,题中为丙烷的球棍模型;
C.四氯化碳的电子式中,氯原子最外层已经达到8电子稳定结构;
D.键线式表示方法:碳碳键用线段来表现,画出键线式.拐点和端点表示碳原子,碳原子,H不必标出,杂原子(非碳、氢原子)不得省略,并且其上连有的氢也一般不省略.
解答 解:A.乙炔的结构简式CH≡CH,碳碳三键不能省略,故A错误;
B. 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故B错误;
,故B错误;
C.四氯化碳为共价化合物,分子中存在4个碳氯共用电子对,碳原子和氯原子最外层都达到8电子稳定结构,四氯化碳正确的电子式为: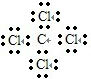 ,故C错误;
,故C错误;
D.2-乙基-1,3-丁二烯的结构简式为 ,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为:
,键线式中用短线“-”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,所以2-乙基-1,3-丁二烯的键线式为: ,故D正确;
,故D正确;
故选D.
点评 本题考查化学用语的使用,涉及结构简式、比例模型与球棍模型、电子式、键线式的判断,化学用语是高考的热点,要熟练掌握常用的化学用语,注意不同化学用语的书写要求,明确球棍模型与比例模型的表示方法,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列分子式表示的物质一定是纯净物的是( )
| A. | C2H60 | B. | C7H8O | C. | CH4O | D. | C2H4Cl2 |
7. 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
 的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )
的同分异构体中,含有苯环且苯环上一氯取代物只有一种的结构共有(不考虑立体异构)( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
17.对于平衡体系:aA(g)+bB(g)?cC(s)+dD(g);△H<0,有下列判断,其中不正确的是( )
| A. | 若容器容积不变,升高温度,各气体的相对分子质量一定增大 | |
| B. | 若从正反应开始,平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 达到平衡时,有amol A消耗的同时有b mol B生成 | |
| D. | 若容器为体积不变的密闭容器且a+b=c+d,则当升高容器内温度时平衡向左移动,容器中气体的压强增大 |
4.下列能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成S.
①HCl比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成S.
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③ |
1. 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )| A. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| B. | 将此氨水稀释,溶液的导电能力减弱 | |
| C. | c点时消耗盐酸体积V(HCl)<20 mL | |
| D. | 室温下,a点的氨水电离常数为$\frac{1{0}^{2(a-14)}}{1-1{0}^{a-14}}$ mol•L-1 |