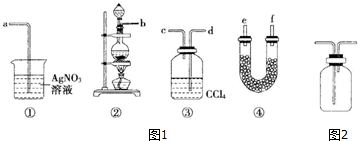
题目内容
17.对于平衡体系:aA(g)+bB(g)?cC(s)+dD(g);△H<0,有下列判断,其中不正确的是( )| A. | 若容器容积不变,升高温度,各气体的相对分子质量一定增大 | |
| B. | 若从正反应开始,平衡时A、B的转化率相等,则A、B的物质的量之比为a:b | |
| C. | 达到平衡时,有amol A消耗的同时有b mol B生成 | |
| D. | 若容器为体积不变的密闭容器且a+b=c+d,则当升高容器内温度时平衡向左移动,容器中气体的压强增大 |
分析 A、若容器容积不变,升高温度,化学平衡向吸热方向移动;
B、转化率等于参加反应的物质与物质的初始浓度之比;
C、达到平衡时,正逆反应速率相等;
D、升高温度,化学反应向吸热方向移动.
解答 解:A、若容器容积不变,升高温度,化学平衡向吸热方向移动即逆反应方向移动,虽然气体的总质量增大,但a+b与d的大小关系不知,所以气体的相对分子质量不一定增大,故A错误;
B、该反应中,A和B以计量数之比进行反应,当平衡时,A、B的转化率相等,则起始时A、B的物质的量之比为a:b,故B正确;
C、达到平衡时,正逆反应速率相等,所以有amol A消耗的同时有b mol B生成,故C正确;
D、若a+b=c+d,则对于体积不变的容器,升高温度,平衡向逆反应方向移动,根据PV=nRT知,容器中气体的压强增大,故D错误.
故选B.
点评 本题考查化学平衡移动的影响因素以及反应热问题,题目难度中等.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | s能级原子轨道呈球形,其电子运动轨迹呈球形 | |
| B. | P能级轨道数随电子层数递增而增多 | |
| C. | 在基态多电子原子中,N层上的电子能最一定比M层上的高 | |
| D. | 在基态多电子原子中,不可能有两个运动状态完全相同的电子 |
5.随着化石能源的日益减少,能源危机成为目前人类面临的重要问题.主要利用化学方法产生新能源的事例为( )
| A. | 风力发电 | B. | 潮汐能发电 | ||
| C. | 水力发电 | D. | 太阳能光解水制取H2 |
12.下列化学用语正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: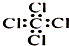 | D. | 2-乙基-1,3-丁二烯分子的键线式: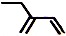 |
2.某主族元素的最高价含氧酸的阴离子的符号是RO3-,则该元素的气态氢化物的化学式是( )
| A. | HR | B. | H2R | C. | RH3 | D. | RH4 |
7.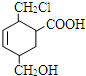 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤还原反应⑥消去反应.
 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤还原反应⑥消去反应.
| A. | ①③④⑤⑥ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | 全部 |