题目内容
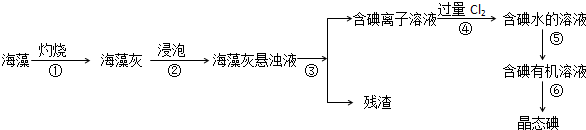
1. 室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
室温下,向20.00mL 1.000mol•L-1氨水中滴入1.000mol•L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )| A. | a、d两点的溶液,水的离子积Kw(a)>Kw(d) | |
| B. | 将此氨水稀释,溶液的导电能力减弱 | |
| C. | c点时消耗盐酸体积V(HCl)<20 mL | |
| D. | 室温下,a点的氨水电离常数为$\frac{1{0}^{2(a-14)}}{1-1{0}^{a-14}}$ mol•L-1 |
分析 A.温度越高,水的离子积常数越大;
B.溶液的导电能力与离子浓度呈正比;
C.氯化铵是强酸弱碱盐,其水溶液呈酸性,要使溶液呈中性,则氨水应该稍微过量;
D.电离平衡常数K=$\frac{{c}^{2}(O{H}^{-})}{1-c(O{H}^{-})}$.
解答 解:A.温度越高,水的电离程度越大,a点的温度小于d点,所以a、d两点的溶液,水的离子积Kw(a)<Kw(d),故A错误;
B.稀释氨水,虽然促进一水合氨电离,但溶液中离子浓度减小,所以导电能力降低,故B正确;
C.氯化铵是强酸弱碱盐,其水溶液呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以c点时消耗盐酸体积V(HCl)<20mL,故C正确;
D.电离平衡常数K=$\frac{{c}^{2}(O{H}^{-})}{1-c(O{H}^{-})}$=$\frac{(1{0}^{a-14})^{2}}{1-1{0}^{a-14}}$mol/L,故D正确;
故选A.
点评 本题考查弱电解质的电离,明确弱电解质的电离特点是解本题关键,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.下列化学用语正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: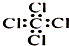 | D. | 2-乙基-1,3-丁二烯分子的键线式: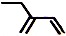 |
13.下列有关实验操作说法中,不正确的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 可用渗析的方法除去淀粉中混有的少量NaCl杂质 | |
| C. | 在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体 | |
| D. | 仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的H2SO4和CH3COOH溶液 |
10.从海水(含氯化镁)中提取镁,涉及如下步骤:
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
| A. | 正确操作步骤的顺序是⑤②③①④ | |
| B. | 步骤④电解时阴极产生氯气 | |
| C. | 直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2 | |
| D. | 此法提取镁的过程中涉及置换、分解、化合和复分解反应 |
11.镁条在下列那种气体中无法燃烧( )
| A. | O2 | B. | N2 | C. | Ar | D. | CO2 |
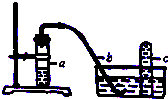 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.