题目内容
5.无水氯化铝(沸点182.7℃)遇潮湿空气即会发生反应产生大量白雾,现欲用下列装置制备无水氯化铝.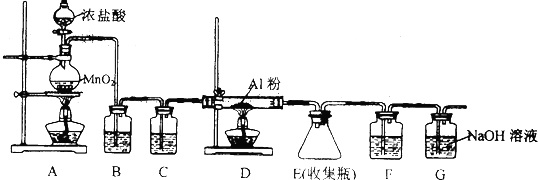
(1)A装置中发生反应的化学方程式MnO2+4HCl(浓)△_△––––––MnCl2+Cl2↑+2H2O.
(2)连接好实验装置,接下来的操作顺序是DBECA(填序号).
A.加热开始反应 B.往烧瓶中加入从MnO2粉末
C.往烧瓶中滴加浓盐酸 D.检査装置气密性 E.向分液漏斗中添加浓盐酸
(3)B装置的作用是吸收氯气中的氯化氢,C装罝中试剂是浓硫酸.
(4)用某仪器装填适当试剂后可起到F和G的作用,所装填的试剂为c(填序号). a.浓硫酸 b.无水氯化钙c.碱石灰.
分析 (1)二氧化锰与浓盐酸反应生成氯气和氯化锰和水;
(2)连接好仪器后应先检验装置的气密性在加入药品,然后加热发生反应制取,据此解答;
(3)制取的氯气中含有氯化氢和水蒸气,进入D前应进行除杂;
(4)F的作用分别是防止空气中的水蒸气进入E,G的作用吸收过量的氯气,防止污染空气,结合碱石灰成分性质解答.
解答 解:(1)二氧化锰与浓盐酸反应生成氯气和氯化锰和水,方程式:MnO2+4HCl(浓)△_△––––––MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)△_△––––––MnCl2+Cl2↑+2H2O;
(2)连接好仪器后应先检验装置的气密性在加入药品,然后加热发生反应制取,正确的顺序为:DBECA;
故答案为:DBECA;
(3)氯化氢易挥发,制取的氯气中含有氯化氢和水蒸气,氯化氢在水中溶解度较大,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水吸收氯化氢,浓硫酸具有吸水性,能够干燥氯气;
故答案为:吸收氯气中的氯化氢;浓硫酸;
(4)F的作用分别是防止空气中的水蒸气进入E,G的作用吸收过量的氯气,防止污染空气,而碱石灰成分为氢氧化钠和氧化钙,能够吸收氯气和水,
故选:c.
点评 本题考查了无水氯化铝的制备,熟悉氯气的制备和性质是解题关键,题目难度不大.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
16.下列化学方程式书写正确的是( )
| A. | Cu+S△_△––––––CuS | B. | 3Cu+8HNO3(浓)═3Cu(N03)2+2N0↑+4H20 | ||
| C. |  +HO-NO2浓硫酸→ +HO-NO2浓硫酸→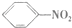 +H2O +H2O | D. | 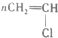 引发剂→ 引发剂→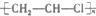 |
17.一定条件下,发生反应:①M(s)+N(g)?R(g)△H=-Q1kJ•mol-1,②2R (g)+N(g)?2T (g)
△H=-Q2kJ•mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
△H=-Q2kJ•mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+Q22kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
12.下列化学用语正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: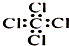 | D. | 2-乙基-1,3-丁二烯分子的键线式: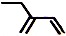 |
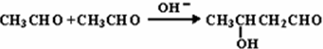
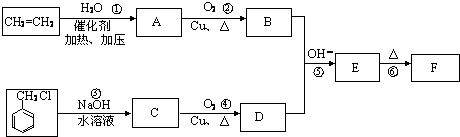
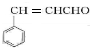 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.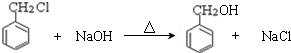
 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于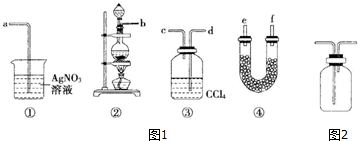
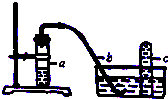 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.