题目内容
2.盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列的3个热化学反应方程式:Fe203(s)+3CO(g)═2Fe(s)+3C02(g)△H=-25kJ/mol
Fe203(s)+$\frac{1}{3}$CO(g)═$\frac{2}{3}$Fe3O4(s)+C02(g)△H=-15.7kJ/mol
Fe304(s)+CO(g)═3FeO(s)+C02(g)△H=+19kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-10.98kJ/mol.
分析 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol ①
Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+CO2(g)△H=-15.7kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol ③
根据盖斯定律由①-②-③×$\frac{2}{3}$计算得到.
解答 解:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ/mol ①
Fe2O3(s)+$\frac{1}{3}$CO(g)=$\frac{2}{3}$Fe3O4(s)+CO2(g)△H=-15.7kJ/mol ②
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+19kJ/mol ③
由①-②-③×$\frac{2}{3}$得
2CO(g)+2FeO(s)=2Fe(s)+2CO2(g)△H=-25kJ/mol-(-15.7kJ/mol)-(+19kJ/mol)×$\frac{2}{3}$=-21.96kJ/mol,
即 CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-10.98kJ/mol
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-10.98kJ/mol.
点评 本题考了应用查盖斯定律进行反应热的计算,热化学方程式的书写,容易出错,题目有一定的难度.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
12.下列化学用语正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: | D. | 2-乙基-1,3-丁二烯分子的键线式: |
13.下列有关实验操作说法中,不正确的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 可用渗析的方法除去淀粉中混有的少量NaCl杂质 | |
| C. | 在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体 | |
| D. | 仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的H2SO4和CH3COOH溶液 |
10.从海水(含氯化镁)中提取镁,涉及如下步骤:
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
| A. | 正确操作步骤的顺序是⑤②③①④ | |
| B. | 步骤④电解时阴极产生氯气 | |
| C. | 直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2 | |
| D. | 此法提取镁的过程中涉及置换、分解、化合和复分解反应 |
17.对于可逆反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 达到化学平衡时,4υ正(O2)=5υ逆(NO ) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 恒温、恒容时,当混合气体的密度不再变化时,表示反应达到了化学平衡状态 | |
| D. | 化学反应速率关系是:2υ正(NH3)=3υ正(H2O) |
7.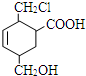 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤还原反应⑥消去反应.
 某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )
某有机物的结构简式如图所示,它在一定条件下可能发生的反应是( )①加成反应 ②水解反应 ③酯化反应 ④氧化反应 ⑤还原反应⑥消去反应.
| A. | ①③④⑤⑥ | B. | ①②③④⑤ | C. | ①③⑤⑥ | D. | 全部 |
14.在25℃水中加入下列物质,不会使水的电离平衡发生移动的是( )
| A. | KI | B. | 浓氨水 | C. | 冰醋酸 | D. | 热水 |
11.镁条在下列那种气体中无法燃烧( )
| A. | O2 | B. | N2 | C. | Ar | D. | CO2 |
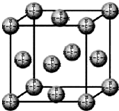 (1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题:
(1)2003年夏,全球化学家投票评选了化学史上十项最美的实验,1848年巴斯德用手工在光学显微镜下把左型酒石酸盐晶体和右型酒石酸盐晶体分开的实验被选为十项之首.请回答下列问题: .
.