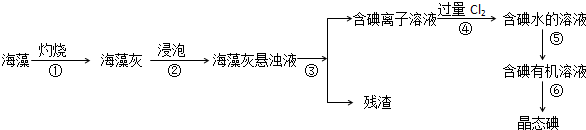
题目内容
3.(1)甲烷、氢气、一氧化碳燃烧热分别为 akJ•mol-1,bkJ•mol-1,ckJ•mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为CH4(l)+CO2(g)=2CO(g)+2H2(g)△H=-(a-2b-2c)kJ•mol-1.(2)在室温下,下列溶液中①0.1mol/LCH3COONH4,②0.1 mol/L NH4HSO4,③0.1mol/L NH3•H2O
④0.1mol/LNH4Cl,请根据要求回答问题:
溶液①和②中c(NH4+)的大小关系是①<②(填“>”、“<”或“=”).
将一定体积的溶液③和溶液④混合,所得溶液的pH=7,则该溶液中离子浓度的由大到小顺序是:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
(3)25℃时,将一定体积和浓度的醋酸与醋酸钠溶液相混合,若所得混合液pH=6,则该混合液中c(CH3COO-)-c(Na+)=9.9×10-7mol/L.
分析 (1)根据甲烷、氢气、一氧化碳的燃烧热分先书写热方程式,再利用盖斯定律来分析天燃气和二氧化碳反应制备合成气(CO、H2)的热化学方程式;
(2)醋酸根离子促进了铵根离子的水解,硫酸氢铵中氢离子抑制了铵根离子的水解;溶液的pH=7,反应后溶液为中性,则c(OH-)=c(H+),根据电荷守恒可知:c(Cl-)=c(NH4+);
(3)pH=6溶液中,c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)计算.
解答 解:(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ•mol-1,bkJ•mol-1,ckJ•mol-1,则
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-ckJ•mol-1
②CH4(l)+2O2(g)=CO2(g)+2 H2O(l)△H=-akJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-bkJ•mol-1
由盖斯定律可知用②-①×2-③×2得反应CH4(l)+CO2(g)=2CO(g)+2H2(g),
该反应的反应热△H=-akJ•mol-1-(-2c)kJ•mol-1-(-2bkJ•mol-1)=-(a-2b-2c)kJ•mol-1,
故答案为:CH4(l)+CO2(g)=2CO(g)+2H2(g)△H=-(a-2b-2c)kJ•mol-1;
(2)CH3COONH4溶液中醋酸根离子促进了铵根离子的水解,NH4HSO4溶液中氢离子抑制了铵根离子的水解,则溶液①和②中c(NH4+)的大小关系是①<②;
将一定体积的溶液③0.1mol/L NH3•H2O、④0.1mol/LNH4Cl混合,所得溶液的pH=7,反应后溶液为中性,则c(OH-)=c(H+),根据电荷守恒可知:c(Cl-)=c(NH4+),则溶液中离子浓度当大小为:c(Cl-)=c(NH4+)>c(OH-)=c(H+),
故答案为:<; c(Cl-)=c(NH4+)>c(OH-)=c(H+);
(3)pH=6溶液中c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-)可知:c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L,
故答案为:9.9×10-7 mol/L.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理及其影响、热化学方程式的书写、离子浓度大小比较等知识,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中应用方法,明确热化学方程式的书写原则.

| A. | s能级原子轨道呈球形,其电子运动轨迹呈球形 | |
| B. | P能级轨道数随电子层数递增而增多 | |
| C. | 在基态多电子原子中,N层上的电子能最一定比M层上的高 | |
| D. | 在基态多电子原子中,不可能有两个运动状态完全相同的电子 |
| A. | 需要点燃后才能发生反应,所以这个反应为吸热反应 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
| A. | 风力发电 | B. | 潮汐能发电 | ||
| C. | 水力发电 | D. | 太阳能光解水制取H2 |
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: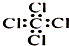 | D. | 2-乙基-1,3-丁二烯分子的键线式: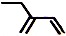 |
①将沉淀物与盐酸反应,结晶、过滤 ②在HCl气体氛围中干燥产物
③过滤、洗涤沉淀物 ④将得到的产物熔融电解得到镁
⑤把贝壳制成石灰乳[Ca(OH)2],在引入的海水中加入石灰乳,沉降.
下列说法正确的是( )
| A. | 正确操作步骤的顺序是⑤②③①④ | |
| B. | 步骤④电解时阴极产生氯气 | |
| C. | 直接在空气中将MgCl2溶液蒸干可得到Mg(OH)2 | |
| D. | 此法提取镁的过程中涉及置换、分解、化合和复分解反应 |
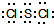 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于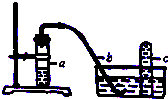 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.