题目内容
4.下列能说明氯的非金属性比硫强的事实是( )①HCl比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成S.
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①②③ |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断.
解答 解:①元素的非金属性越强,对应氢化物的稳定性越强,氯化氢比硫化氢稳定,可说明氯元素的非金属性比硫元素强,故①正确;
②元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,HClO4酸性比H2SO4强,可说明氯元素的非金属性比硫元素强,故②正确;
③Cl2能与H2S反应生成S,非金属性强的单质能把非金属性弱的单质置换出来,故③正确,故选D.
点评 本题考查非金属性的判断,题目难度不大,注意非金属性的递变规律以及比较非金属性的角度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.一定条件下,发生反应:①M(s)+N(g)?R(g)△H=-Q1kJ•mol-1,②2R (g)+N(g)?2T (g)
△H=-Q2kJ•mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
△H=-Q2kJ•mol-1. Q1、Q2、Q3均为正值.下列说法正确的是( )
| A. | 1 mol R(g)的能量总和大于1 mol M(s)与1 mol N(g) 的能量总和 | |
| B. | 将2 mol R (g)与1 mol N(g)在该条件下充分反应,放出热量Q2 kJ | |
| C. | 当1 mol M(s) 与N(g)完全转化为T (g)时(假定无热量损失),放出热量Q1+$\frac{{Q}_{2}}{2}$kJ | |
| D. | M(g)+N(g)?R(g)△H=-Q3 kJ•mol-1,则Q3<Q1 |
18.对于反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | 需要点燃后才能发生反应,所以这个反应为吸热反应 | |
| B. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量大于形成2molH-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
12.下列化学用语正确的是( )
| A. | 乙炔的结构简式:CHCH | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: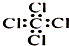 | D. | 2-乙基-1,3-丁二烯分子的键线式: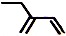 |
19.下列说法正确的是( )
| A. | 在101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ热量,H2的燃烧热为-285.8kJ•mol-1 | |
| B. | 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度 | |
| C. | 在101k Pa时,1mol C与适量O2 反应生成1mol CO时,放出110.5kJ热量,则C的燃烧热为110.5kJ•mol-1 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l),△H=-57.31 kJ•mol-1.若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ |
13.下列有关实验操作说法中,不正确的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 可用渗析的方法除去淀粉中混有的少量NaCl杂质 | |
| C. | 在进行过滤操作时,为了加快过滤速率,可用玻璃棒不断搅拌过滤器中的液体 | |
| D. | 仅用量筒、试管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的H2SO4和CH3COOH溶液 |
14.在25℃水中加入下列物质,不会使水的电离平衡发生移动的是( )
| A. | KI | B. | 浓氨水 | C. | 冰醋酸 | D. | 热水 |