题目内容
7.用NA表示阿伏德罗常数,下列叙述正确的( )| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N | |
| C. | 通常状况下,1 NA个CO2分子占有的体积为22.4L | |
| D. | 标准状况下,22.4L CO2和SO2混合气中氧原子数为0.2NA |
分析 A、标况下,水为液态;
B、求出Na2CO3的物质的量,然后根据1molNa2CO3含2mol钠离子;
C、通常状况下,气体摩尔体积大于22.4L/mol;
D、1molCO2和SO2均含2mol氧原子.
解答 解:A、标况下,水为液态,不能根据气体摩尔体积来计算,故A错误;
B、1.06gNa2CO3的物质的量为0.01mol,而1molNa2CO3含2mol钠离子,故0.01mol碳酸钠中含0.02mol,即0.02NA个,故B正确;
C、通常状况下,气体摩尔体积大于22.4L/mol,故NA个CO2分子即1mol二氧化碳的体积大于22.4L,故C错误;
D、标准状况下,22.4L CO2和SO2混合气体的物质的量为1mol,1molCO2和SO2均含2mol氧原子,故1molCO2和SO2混合气体中含2mol氧原子,即2NA个,与CO2和SO2所占的比例无关,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
17.下列关于有机物的叙述不正确的是( )
| A. | 甲烷、甲苯、乙醇、乙酸都可以发生取代反应 | |
| B. | 能发生银镜反应的有机物都是醛 | |
| C. | 乙酸乙酯在无机酸或碱存在时都能发生水解反应 | |
| D. | 可用浓溴水来区分乙醇和苯酚 |
18.已知某含苯环的分子C8H10,苯环上有两个侧链,其一氯取代物的种数是(不考虑立体异构)( )
| A. | 10种 | B. | 9种 | C. | 6种 | D. | 5种 |
15.可逆反应2SO2+O2?2SO3达到平衡的标志是( )
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变.
①消耗2mol SO2的同时生成2mol SO3
②SO2、O2与SO3的物质的量之比为2:1:2
③反应混合物中,SO3的质量分数不再改变.
| A. | ①② | B. | ①③ | C. | 只有③ | D. | 全部 |
2.下列指定微粒的个数比为2:1的是( )
| A. | Be2+中的质子和电子 | |
| B. | NaHCO3晶体中的阳离子和阴离子 | |
| C. | ${\;}_{1}^{2}$H原子中的中子和质子 | |
| D. | BaO2(过氧化钡)固体中的阴离子和阳离子 |
12.甲、乙两烧杯分别装有100mL相同pH的氨水和氢氧化钠溶液,向其中各加入10mL 0.1mol/L AlCl3溶液,两烧杯中都有沉淀生成,下列判断错误的是( )
| A. | 两烧杯中的沉淀可能一样多 | |
| B. | 两烧杯中沉淀的最大可能值均为0.078g | |
| C. | 反应后两烧杯中溶液的pH可能:甲<乙 | |
| D. | 两烧杯中反应的离子方程式不同 |
7.下图中,能表示灼热的炭与二氧化碳反应的能量变化的是( )
| A. | 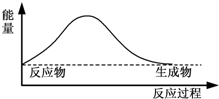 | B. | 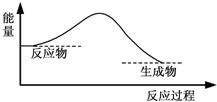 | ||
| C. | 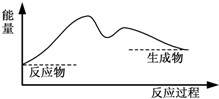 | D. | 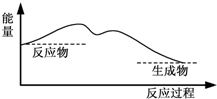 |
4.6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.下列有关说法不正确的是( )
| X | Y | Z | |
| W | M | Q |
| A. | W的最高价氧化物可以和Z的氢化物反应 | |
| B. | X、Y、Z三种元素的原子半径由大到小的顺序为Z>Y>X | |
| C. | X的含10个电子的气态氢化物可以与X的最高价氧化物对应的水化物溶液反应生成盐 | |
| D. | 工业上电解Q元素的钠盐溶液可获得一种含Q元素的消毒剂 |
5.下列事实中能证明某化合物中一定是离子化合物的是( )
| A. | 可溶于水 | B. | 含有金属元素 | C. | 水溶液可导电 | D. | 熔融状态能导电 |