题目内容
5.下列事实中能证明某化合物中一定是离子化合物的是( )| A. | 可溶于水 | B. | 含有金属元素 | C. | 水溶液可导电 | D. | 熔融状态能导电 |
分析 熔融状态下能导电的化合物中一定含有阴阳离子,由阴阳离子构成的化合物为离子化合物,据此分析解答.
解答 解:A.可溶于水的化合物不一定是离子化合物,如氨气,故A错误;
B.含有金属元素的化合物不一定是离子化合物,如氯化铝,故B错误;
C.水溶液能导电的化合物不一定是离子化合物,如氯化氢、硫酸等,故C错误;
D.熔融状态能导电的化合物中一定含有阴阳离子,由阴阳离子构成的化合物为离子化合物,所以一定是离子化合物,故D正确;
故选D.
点评 本题考查离子化合物和共价化合物判断,侧重考查基本概念,只有离子化合物在熔融状态下能导电,注意不能根据溶解性、水溶液导电性、是否含有金属元素判断离子化合物,为易错点.

练习册系列答案
相关题目
7.用NA表示阿伏德罗常数,下列叙述正确的( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N | |
| C. | 通常状况下,1 NA个CO2分子占有的体积为22.4L | |
| D. | 标准状况下,22.4L CO2和SO2混合气中氧原子数为0.2NA |
16.在通常情况下能大量共存,并且可以用浓硫酸干燥的一组气体是( )
| A. | SO2、H2S、O2 | B. | CO、H2、Cl2 | C. | NO、H2、O2 | D. | HCl、CO、NH3 |
20.原子序数为83的元素位于:①第5周期;②第6周期;③ⅣA族;④ⅤA族;⑤ⅡB族.其中正确的组合是( )
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ①⑤ |
17.某元素的原子核外有三个电子层,其中M电子数是L层电子数的一半,则此元素( )
| A. | C | B. | Si | C. | S | D. | C1 |
14.下列条件下的反应,放出H2最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 3mol/L HCl | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Mg | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Mg | 0.1 | 3mol/L HNO3 | 10 | 30℃ |
| A. | A | B. | B | C. | C | D. | D |
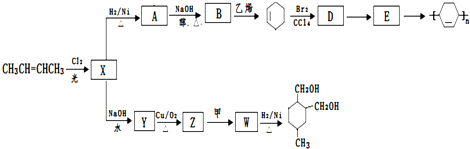
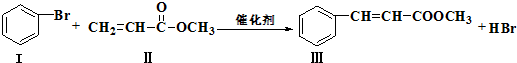
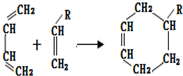 (或写成
(或写成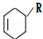 R代表取代基或氢)
R代表取代基或氢) .
.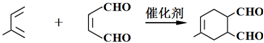 .
.
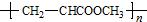 .
.
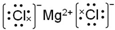 .
.