题目内容
12.甲、乙两烧杯分别装有100mL相同pH的氨水和氢氧化钠溶液,向其中各加入10mL 0.1mol/L AlCl3溶液,两烧杯中都有沉淀生成,下列判断错误的是( )| A. | 两烧杯中的沉淀可能一样多 | |
| B. | 两烧杯中沉淀的最大可能值均为0.078g | |
| C. | 反应后两烧杯中溶液的pH可能:甲<乙 | |
| D. | 两烧杯中反应的离子方程式不同 |
分析 因氨水和NaOH溶液中,各加入10mL 0.1mol•L-1 AlCl3溶液,生成氢氧化铝沉淀,一水合氨为弱电解质,部分电离,氢氧化钠为强电解质,完全电离,相同体积、相同pH的氨水和NaOH溶液中的溶质一水合氨的物质的量远大于氢氧化钠的物质的量;
当两者都不足量时,生成的氢氧化铝沉淀的量由一水合氨和氢氧化钠来决定,一水合氨的物质的量大于氢氧化钠的物质的量,所以甲中沉淀比乙中的多;
当氨水过量,氢氧化钠不足时,甲中生成的氢氧化铝的物质的量=10mL×10-3L/mL×0.1mol•L-1=0.001mol,乙中生成的氢氧化铝的物质的量小于0.001mol,所以甲中沉淀比乙中多;
氨水过量,氢氧化钠恰好时,生成的沉淀取决于氯化铝,氯化铝的量相等,所以甲和乙中生成的沉淀一样多;
氨水和氢氧化钠都过量时,因氢氧化铝能溶于氢氧化钠但不溶于氨水,甲中生成的氢氧化铝为0.001mol,乙中生成的0.001mol氢氧化铝部分溶于过量的氢氧化钠,所以甲中沉淀比乙中多,据此分析解答.
解答 解:一水合氨是弱电解质、NaOH是强电解质,所以相同pH的氨水和NaOH溶液,c(氨水)>c(NaOH),相同体积、相同pH的氨水和NaOH溶液,n(氨水)>n(NaOH),二者和氯化铝反应都生成氢氧化铝沉淀,但氢氧化铝能溶于强碱NaOH,但不溶于弱碱氨水,
A、如果AlCl3不足量,则二者生成沉淀由AlCl3决定,AlCl3的物质的量相等,所以生成沉淀质量相等,故A正确;
B、根据铝守恒10mL 0.1mol/L AlCl3溶液,生成沉淀最大量为0.001mol,所以沉淀的最大可能值均为0.078g,故B正确;
C、当氢氧化钠与氯化铝恰好完全反应生成氢氧化铝时,而甲中氨水过量,电离呈碱性,所以反应后两烧杯中溶液的pH可能:甲>乙,故C错误;
D、一水合氨是弱电解质,而氢氧化钠是强电解质,两烧杯中反应的离子方程式不同,故D正确;
故选C.
点评 此题考查了元素化合物知识,此题解答时,根据氢氧化铝的性质采用讨论的方法进行解答,能正确进行分段是解本题的关键,所以在应用讨论法解题时,关键是先要分析条件与求解问题之间的联系,形成正确的解题方法,难度较大.

| A. | 1mol苯乙烯中含有的碳碳双键数为4NA | |
| B. | 0.1mol甲基中含有的电子数为NA | |
| C. | 2.8 g乙烯和聚乙烯的混合物中所含碳原子数为0.2NA | |
| D. | 标准状况下,2.24LCHCl3含有的分子数为0.1NA |
CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H2=-282.57kJ•mol-1
则C(s)+O2(g)═CO2(g);△H3为( )
| A. | +172.22 kJ•mol-1 | B. | -172.22 kJ•mol-1 | ||
| C. | +392.92 kJ•mol-1 | D. | -392.92 kJ•mol-1 |
| A. | COS分子是含有极性键的极性分子 | |
| B. | COS的电子式为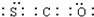 | |
| C. | COS分子中所有原子都满足8电子稳定结构 | |
| D. | COS属于离子化合物 |
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N | |
| C. | 通常状况下,1 NA个CO2分子占有的体积为22.4L | |
| D. | 标准状况下,22.4L CO2和SO2混合气中氧原子数为0.2NA |
| A. | 含4 mol HCl 的浓盐酸跟足量MnO2加热反应可制得 Cl2的分子数为NA | |
| B. | 将标准状况下 22.4LNO与11.2LO2混合后的体积约为 22.4L | |
| C. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| D. | 1molC(金刚石)中含有C-C键的数目为4NA |
| A. | NaHS溶液水解:HS-+H2O?S2-+H3O+ | |
| B. | 向Ca(C1O)2溶液中通入SO2:SO2+2ClO-+H2O=SO32-+2HClO | |
| C. | 硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至SO42ˉ刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O |
 .
.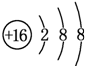 ;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为
;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为S=C=S,电子式为 ,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
,化学键类型为极性共价键(填“离子键”、“非极性共价键”或“极性共价键”).
 .
.