题目内容
3.原子轨道的杂化不但出现在分子中,原子团中同样存在原子的杂化.在SO42-中S原子的杂化方式是( )| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:硫酸根离子中S原子价层电子对个数=4+$\frac{1}{2}$×(6+2-4×2)=4,所以采用sp3杂化,故选C.
点评 本题考查原子杂化方式判断,为高频考点,明确价层电子对互斥理论内涵即可解答,价层电子对互斥理论可以判断原子杂化方式、微粒空间构型,题目难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
13.下列说法中正确的是( )
| A. | 在分子中,两个成键的原子间的距离叫键长 | |
| B. | H-Cl键比H-I键稳定 | |
| C. | 含有极性键的一定是极性分子 | |
| D. | 键能越大,说明该分子越易受热分解 |
14.下列有关性质的比较中,正确的是( )
| A. | 热稳定性:H2S>HCl>HBr>HI | B. | 熔点:Na2O>MgO>CaO | ||
| C. | 微粒半径:F-<Na+<Mg2+ | D. | 还原性:H2S>HCl>HF |
18.将Mg、Cu组成的混合物13.2g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体4.48L(无其他还原产物),向反应后的溶液中加入过量的2.5mol•L-1的NaOH溶液300mL,金属离子完全沉淀.则形成沉淀的质量是( )
| A. | 21.6g | B. | 26.8g | C. | 23.4g | D. | 31.9g |
6.下列各组物质中化学键的类型相同的是( )
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2S | D. | NH3 H2O CO2 |
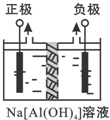 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题: