题目内容
13.下列说法中正确的是( )| A. | 在分子中,两个成键的原子间的距离叫键长 | |
| B. | H-Cl键比H-I键稳定 | |
| C. | 含有极性键的一定是极性分子 | |
| D. | 键能越大,说明该分子越易受热分解 |
分析 A.分子中两个成键原子的核间平均距离叫做键长键长;
B.键能越大,表示该分子越稳定;
C.由极性键构成的分子,结构对称,正负电荷的中心重合,则为非极性分子;
D.键能越大,表示该分子越稳定,受热难分解.
解答 解:A.键长是分子中两个成键原子的核间平均距离,不是两个成键的原子间的距离,故A错误;
B.H-Cl的键能大于H-I的键能,则HCl分子比HI分子稳定,故B正确;
C.含有极性键的分子不一定为极性分子,如:CO2中有C、O元素之间形成极性键,且分子结构对称,正负电荷的中心重合,属于非极性分子,故C错误;
D.键能越大,说明该分子越稳定,受热越难分解,故D错误;
故选B.
点评 本题考查了键长、分子的极性以及键能与分子稳定性的关系,题目难度不大,注意掌握分子极性与键的极性的关系,明确键能与物质稳定性的关系.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
3.下列说法不正确的是( )
| A. | 福岛核电站泄漏的放射性物质中131I和127I互为同位素,化学性质几乎相同 | |
| B. | “光化学烟雾”、“硝酸酸雨”的形成都与氮氧化合物有关 | |
| C. | 由分子组成的物质中不一定存在共价键 | |
| D. | 熔融状态能导电的物质一定是离子化合物 |
4.随着卤素原子半径的增大,下列递变规律正确的是( )
| A. | 单质氧化性逐渐增强 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 卤素离子的还原性逐渐增强 | D. | 气态氢化物稳定性逐渐增强 |
1.下列反应中,不能生成Al(OH)3沉淀的是( )
| A. | 氧化铝和水 | B. | 三氯化铝和氨水 | ||
| C. | 氧化铝和强碱溶液 | D. | 铝和强碱溶液 |
8.下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A. | 2F2+2H2O═4HF+O2 | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O |
5.下列除去杂质的方法可行的是( )
| A. | 除去二氧化碳中混有的少量一氧化碳气体,通入过量氧气并点燃 | |
| B. | 除去碳酸氢钠固体中少量的碳酸钠固体,用加热法 | |
| C. | 除去CO2中少量的HCl:将气体通过盛饱和烧碱溶液的洗气瓶 | |
| D. | 除去铁中混有的少量铝,将固体投入足量NaOH溶液经充分反应后过滤 |
2.下列关于各实验装置图的叙述中,正确的是( )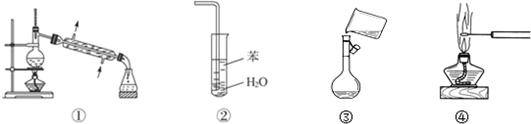

| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收NH3,并防止倒吸 | |
| C. | 图③是将溶解好的溶液转移到容量瓶中 | |
| D. | 图④可观察NaCl的焰色反应 |
3.原子轨道的杂化不但出现在分子中,原子团中同样存在原子的杂化.在SO42-中S原子的杂化方式是( )
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |