题目内容
9.短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和臭鸡蛋气味的气体E,氢氧化物D既能溶于强酸,也能溶于强碱.A在空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成.请回答下列问题:
(1)组成单质A的元素位于周期表中第三周期第ⅥA族.
(2)C与水反应的化学方程式为:Al2S3+6H2O=2Al(OH)3↓+3H2S↑.
(3)G与氯酸钠在酸性溶液中反应可生成消毒剂二氧化氯.该反应的氧化产物为Na2SO4 (填化学式)
当生成2mol二氧化氯时,转移电子2mol
(4)酸雨在放置过程中pH不断减小,用化学方程式解释其主要原因2H2SO3+O2=2H2SO4.
分析 短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和有臭鸡蛋气味的气体E,D既能溶于强酸,也能溶于强碱,则D为Al(OH)3,E为H2S,C为Al2S3,所以A为S,B为Al,E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成,G为SO2,以此解答该题.
解答 解:短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和有臭鸡蛋气味的气体E,D既能溶于强酸,也能溶于强碱,则D为Al(OH)3,E为H2S,C为Al2S3,所以A为S,B为Al,E在足量空气中燃烧产生刺激性气味气体G,G在大气中能导致酸雨的形成,G为SO2,
(1)A为S,位于元素周期表中第三周期ⅥA族,故答案为:三;ⅥA;
(2)C为Al2S3,它与水反应的化学反应方程式为Al2S3+6H2O=2Al(OH)3+3H2S↑,
故答案为:Al2S3+6H2O=2 Al(OH)3↓+3 H2S↑;
(3)G为SO2,G与氯酸钠在酸性溶液中反应可生成消毒剂二氧化氯,反应中S元素化合价升高,则Na2SO4为氧化产物,SO2中S元素的化合价由+4升高为+6,则Cl元素的化合价由+5降低为+4,所以生成2mol二氧化氯时,转移电子2mol×(5-4)=2mol,
故答案为:Na2SO4;2;
(4)酸雨中含有亚硫酸,具有还原性,可被氧化生成硫酸,酸性增强,方程式为2H2SO3+O2=2H2SO4,故答案为:2H2SO3+O2=2H2SO4.
点评 本题主要考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,题目涉及离子反应,双水解、氧化还原反应的计算、实验现象的描述等知识点,中等难度,物质的推断是解题的关键,答题时注意常见元素化合物知识的掌握.

| A. | 除去二氧化碳中混有的少量一氧化碳气体,通入过量氧气并点燃 | |
| B. | 除去碳酸氢钠固体中少量的碳酸钠固体,用加热法 | |
| C. | 除去CO2中少量的HCl:将气体通过盛饱和烧碱溶液的洗气瓶 | |
| D. | 除去铁中混有的少量铝,将固体投入足量NaOH溶液经充分反应后过滤 |
| A. | 向烧碱溶液中滴加少量氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |
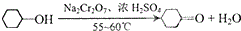 实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):
实验室用Na2Cr2O7氧化环己醇制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表(括号中的数据表示该有机物与水形成的具有固定组成的 混合物的沸点.):
| 物质 | 沸点( ) | 密度(g.cm-3,20) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.9624 | 能溶于水和乙醚 |
| 环己酮 | 155.6(95) | 0.9478 | 微溶于水,能溶于乙醚 |
| 水 | 100.0 | 0.9982 |
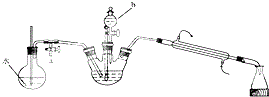
实验步骤如下:
①将重铬酸钠溶液与浓硫酸混合,冷却至室温备用;
②在三颈烧瓶中加入20.0环己醇,并将①中溶液分三次加入三颈烧瓶.控制温度在55℃~60℃之间,充分反应;
③打开活塞a.加热圆底烧瓶,当有大量水蒸气冲出时,关闭活塞a;
④向锥形瓶收集到的粗产品中加入NaCl固体至饱和,静置,分液;
⑤水层用乙醚萃取,萃取液并入有机层;
⑥有机层再加入无水MgSO4固体并过滤,取滤液蒸馏,先除去乙醚(乙醚沸点34.6℃,易燃烧),然后收集151℃~155℃馏分.
根据以上步骤回答下列问题:
(1)仪器b的名称是分液漏斗,步骤①的操作方法是将浓硫酸缓慢加入重铬酸钾溶液中,并不断搅拌.
(2)将①中溶液分三次加入三颈瓶的原因是防止温度过高发生副反应.
(3)步骤③实验操作的目的是水蒸气与环己酮形成的具有固定组成的混合物,蒸馏出产品环己酮,实验过程中要经常检查圆底烧瓶中玻璃管内的水位,当水位上升过高时,应立即进行的操作是打开活塞a.
(4)步骤④中分液时有机层在上(填“上”或“下”)层,蒸馏除乙醚的过程中最好采用的加热方式是水浴加热.
(5)本实验得环己酮12.0g,则环己酮的产率是61.2%.
| A. | X原子的最外层电子数比Y原子的最外层电子数多 | |
| B. | 原子半径:X>Y | |
| C. | 1mol X从酸中置换出来的氢比1mol Y从酸中置换出来的氢多 | |
| D. | X原子的最高正化合价比Y原子的最高正化合价高 |
| A. | 放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 | |
| C. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| D. | 放电时正极附近溶液的碱性增强 |
| A. | 盐酸、空气、醋酸、干冰 | B. | 铁、海水、硫酸钠、乙醇 | ||
| C. | 硫酸、蔗糖、烧碱、石灰石 | D. | 胆矾、漂白粉、氯化钾、硫酸钡 |