题目内容
14.下列有关性质的比较中,正确的是( )| A. | 热稳定性:H2S>HCl>HBr>HI | B. | 熔点:Na2O>MgO>CaO | ||
| C. | 微粒半径:F-<Na+<Mg2+ | D. | 还原性:H2S>HCl>HF |
分析 A.非金属性越强,气态氢化物越稳定;
B.影响离子晶体晶格能大小的因素有电荷因素和半径因素;
C.电子层结构相同,核电荷数越多半径越小;
D.中心元素非金属越弱对应氢化物的还原性越强.
解答 解:A.非金属性Cl>Br>I>S,非金属性越强,气态氢化物越稳定,所以稳定性为:HCl>HBr>HI>H2S,故A错误;
B.先比较电荷数多的晶格能大,而如果电荷数一样多比较核间距,核间距大的,晶格能小,所以熔点:MgO>CaO>Na2O,故B错误;
C.电子层结构相同,核电荷数越多半径越小,所以F->Na+>Mg2+,故C错误;
D.中心元素非金属越弱对应氢化物的还原性越强,非金属性:S<Cl<F,所以氢化物的还原性:H2S>HCl>HF,故D正确;
故选D.
点评 本题考查元素周期律知识,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.

练习册系列答案
相关题目
4.随着卤素原子半径的增大,下列递变规律正确的是( )
| A. | 单质氧化性逐渐增强 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 卤素离子的还原性逐渐增强 | D. | 气态氢化物稳定性逐渐增强 |
5.下列除去杂质的方法可行的是( )
| A. | 除去二氧化碳中混有的少量一氧化碳气体,通入过量氧气并点燃 | |
| B. | 除去碳酸氢钠固体中少量的碳酸钠固体,用加热法 | |
| C. | 除去CO2中少量的HCl:将气体通过盛饱和烧碱溶液的洗气瓶 | |
| D. | 除去铁中混有的少量铝,将固体投入足量NaOH溶液经充分反应后过滤 |
2.下列关于各实验装置图的叙述中,正确的是( )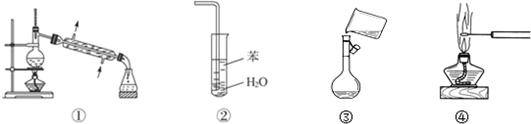

| A. | 装置①常用于分离互不相溶的液体混合物 | |
| B. | 装置②可用于吸收NH3,并防止倒吸 | |
| C. | 图③是将溶解好的溶液转移到容量瓶中 | |
| D. | 图④可观察NaCl的焰色反应 |
9.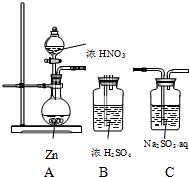 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:
(1)该装置的明显缺陷是:无尾气处理装置
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+写出反应的离子方程式:4Zn+NO3-+10H+=4Zn2++NH4++3H2O 如何验证该猜想:取少量A中反应后的溶液置于试管中,向其中滴加少量氢氧化钠溶液,并加热,在试管口处放置一张湿润的红色石蕊试纸,若试纸变蓝,则猜想成立
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品意选择,合理即可)
(4)乙同学对甲的实验结果产生质疑,提出假设:
假一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二是(“是”或“否”)合理,
理由:3NO2+H2O=2HNO3+NO(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:在一个真空密闭容器中同时通入NO2和SO2,一段时间后,容器中气体的红棕色褪去,证明了二者发生了反应,证明了NO2的氧化性.
 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:(1)该装置的明显缺陷是:无尾气处理装置
(2)实验开始后,发现Zn溶解,但未发现有气体逸出,同学猜想可能是因为HNO3被还原生成NH4+写出反应的离子方程式:4Zn+NO3-+10H+=4Zn2++NH4++3H2O 如何验证该猜想:取少量A中反应后的溶液置于试管中,向其中滴加少量氢氧化钠溶液,并加热,在试管口处放置一张湿润的红色石蕊试纸,若试纸变蓝,则猜想成立
(3)重新调整HNO3浓度后,发现A中有红棕色气体逸出,设计实验,证明NO2具有氧化性(药品意选择,合理即可)
| 步骤 | 现象 | 结论 |
| 取少量C中反应后的溶液 置于试管中, 先加入盐酸溶液酸化,再加入 氯化钡溶液 | 有白色沉淀产生 | NO2具有氧化性 |
假一:NO2氧化了SO32-
假设二:HNO3氧化了SO32-
问题1:假设二是(“是”或“否”)合理,
理由:3NO2+H2O=2HNO3+NO(用化学方程式回答)
问题2:若要验证NO2具有氧化性,你的实验方案是:在一个真空密闭容器中同时通入NO2和SO2,一段时间后,容器中气体的红棕色褪去,证明了二者发生了反应,证明了NO2的氧化性.
19.有钠、镁、铝各n mol,分别与等体积、均与含xmolHCl的盐酸反应,下列说法不正确的是( )
| A. | x<n时,钠生成的氢气最多 | B. | x=n时,钠、镁、铝生成的氢气一样多 | ||
| C. | n<x≤2n时,生成的氢气钠<镁=铝 | D. | x≥2n时,生成的氢气钠<镁<铝 |
6.下列反应的离子方程式不正确的是( )
| A. | 向烧碱溶液中滴加少量氯化铝溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物质的量相等的溴化亚铁跟氯气反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化钾晶体溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸钠溶液中滴加过量的稀硫酸:CO32-+2H+═CO2↑+H2O |
3.原子轨道的杂化不但出现在分子中,原子团中同样存在原子的杂化.在SO42-中S原子的杂化方式是( )
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |