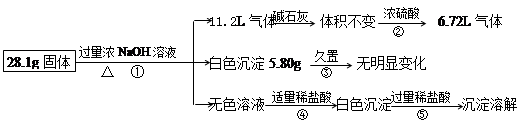题目内容
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(2)由溶液甲生成沉淀乙的离子方程式: ;
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
。
(1)2S2- + SO32- + 6H+ =" 3S↓+" 3H2O; (2分)
(3分,检验SO2、除尽SO2、检验CO2 各1分)步骤 实验目的 试剂 现象 1 检验SO2 品红溶液 红色退去 2 除尽SO2 酸性高锰酸钾溶液 紫色变浅或不完全褪去 3 检验CO2 澄清石灰水 变浑浊 4
(2)Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑; (2分)
(3)S2-、SO32-、AlO2-、Na+、CO32-。 (2分)
(4)取沉淀丙加入足量稀盐酸,若沉淀不能完全溶解,则原溶液中含SO42-,沉淀全部溶解,则原溶液中无SO42-。(答案合理给分)(2分)
解析试题分析:首先分析离子间的反应,如Ag+与题目所给的所以阴离子都能反应,不能大量共存,所以原溶液不含Ag+,然后在根据框图中的现象进一步分析,推出溶液所含的离子。
(1)原溶液不含Ag+,所以淡黄色沉淀甲不是AgBr,为SO32?与S2?在酸性条件下反应生成的S单质沉淀,所以离子方程式为:2S2- + SO32- + 6H+ =" 3S↓+" 3H2O;气体甲由两种氧化物组成(不包括水蒸汽和HBr),因为氢溴酸为强酸,能与CO32?和SO32?反应生成CO2和SO2气体,所以气体甲含有的两种氧化物为SO2和CO2,首先利用SO2的漂白性,通入品红溶液检验SO2,为了防止SO2对CO2检验的干扰,第2步应利用SO2的还原性,通入酸性KMnO4除去SO2,然后再通入澄清石灰水,检验CO2的存在。
(2)因为Ba2+、Al3+不能与CO32?、SO32?共存,所以加入NH4HCO3后产生白色沉淀,说明原溶液含有AlO2-,加入过量氢溴酸后,转化为Al3+,Al3+与HCO3?反应生成Al(OH)3沉淀,离子方程式为:Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑。
(3)根据(1)可推出原溶液含有S2?、SO32?、CO32?;根据(2)可推出原溶液含有AlO2-;Ag+、Ba2+、Al3+与SO32?、CO32?等离子不能大量共存,根据溶液呈中性,所以原溶液还一定含有Na+。
(4)根据题目所给信息不能确定的离子为SO42?,沉淀甲一定含BaCO3,若含有SO42?,沉淀丙中还含有BaSO4,加入足量稀盐酸,沉淀不能完全溶解,若沉淀全部溶解,则原溶液中无SO42-。
考点:本题考查离子的推断、离子方程式的书写、气体的检验。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案在某钠盐溶液中,除Cl-之外可能还含有等物质的量的下列阴离子中的一种或多种:SO32-、CO32-、SiO32-、I-、NO3-、SO42-。在此溶液中加入过量盐酸,产生气泡,溶液颜色变深,但仍澄清,并且原溶液中的阴离子种类减少了3种。试回答下列问题。
(1)原溶液中是否有SiO32-? (填“有”或“没有”),判断理由是 。(用离子方程式表示)
(2)生成的气体中一定有 。它具有的性质是 (填字母序号)。
| A.无色无味 |
| B.无色有刺激性气味 |
| C.属于大气污染物 |
| D.难溶于水 |
(3)原溶液中可能含有的阴离子是 。
(4)溶液中减少的离子是 ,原因是 (用离子方程式表示)。
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。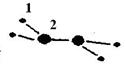
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) 写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
(1)填写下表
| 物质(杂质) | 除去杂质 所需试剂或方法 | 离子方程式 (若无离子方程式,则写化学方程式) |
| Fe(Al) | | |
| SiO2(CaCO3) | | |
| CO2(HCl) | | |
| NaHCO3溶液(Na2CO3) | | |
| Na2CO3(NaHCO3) | | |
| Al2O3(Al(OH)3) | | |
(2)将二氧化硫通入到氯化钡溶液中未见到明显现象,继续通入向该溶液中滴加氯水或氨水,均见到白色沉淀产生,该沉淀的成分分别为 或 ,请分别写出发生反应的离子方程式 , 。
某小组查文献得知:氧化性I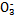 >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2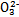
 S4
S4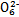 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1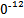 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 | _____________ | |
| 步 骤 2 | 第①份 试液 | 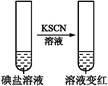 | 碘盐中肯定含 |
| 第②份 试液 | 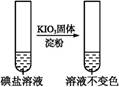 | _____________ | |
| 第③份 试液 | 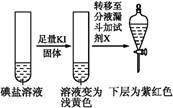 | X为 (填化学式) | |
(2)该碘盐中肯定不含的物质是 (用化学式或离子符号表达)。
(3)根据信息推断Fe3+、S4
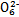 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。 (4)第③份试液中加入足量KI固体后,反应的离子方程式为 、 。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
(1)滴定终点的现象是 。
(2)CuCl2溶液与KI反应的化学方程式为 。
(3)该试样中CuCl2·2H2O的质量分数为 。
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
| A.4KI+O2+2H2O=4KOH+2I2 |
| B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca |
| C.I2+2NaClO3=2NaIO3+Cl2 |
D.MnO2+4HCl MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |