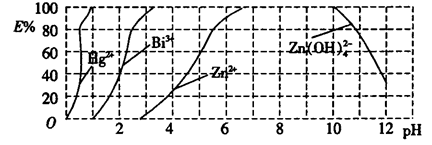
题目内容
某固体混合物可能含Al、(NH4)2SO4、MgCl2、A1Cl3、FeCl2、NaCl中的一种或几
种,现对该混合物作如下实验,所得现象和有关数据如图(气体体积已换算成标准状况下体积),回答下列问题: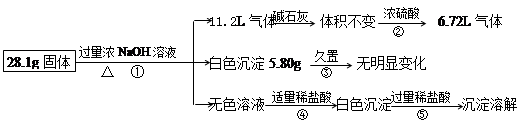
(1)混合物中是否存在FeCl2 ___(填“是”或“否”);
(2)混合物中是否存在(NH4)2SO4 ___(填“是”或“否”),你的判断依据是 。
(3)写出反应④的离子反应式: 。
(4)请根据计算结果判断混合物中是否含有AlCl3_ _(填“是”或“否”),你的判断依据是 。
⑴否 ⑵是,气体通过浓硫酸减少4.48L。
(3)H++OH-=H2O H2O+AlO2-+H+=Al(OH)3↓
(4)否,由题中信息可推得一定含有Al、(NH4)2SO4和MgCl2三种物质,而计算出三者质量之和刚好等于28.1g,所以原混合物中一定没有AlCl3。
解析试题分析:根据反应现象和化学计算判断物质的组成,根据加入氢氧化钠溶液得到白色沉淀,可推出无氯化亚铁;生成的气体通过碱石灰体积不变,而通过浓硫酸减少,说明气体中含有氨气,混合物中含有硫酸铵;③加入盐酸,先和①中过量的氢氧化钠反应,然后盐酸再与偏铝酸根反应,生成白色氢氧化铝沉淀;白色沉淀5.80g为氢氧化镁,可算出化合物中氯化镁的质量,气体通过浓硫酸减少4.48L,为氨气的体积,可求出硫酸铵的质量,剩余的6.72L气体为铝与氢氧化钠溶液反应生成的氢气,然后求出Al、(NH4)2SO4和MgCl2三者质量之和28.1g,正好等于原固体总质量,所以原混合物中一定不含AlCl3。
考点:本题考察物质的推断、离子方程式的书写及化学计算。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(2)由溶液甲生成沉淀乙的离子方程式: ;
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
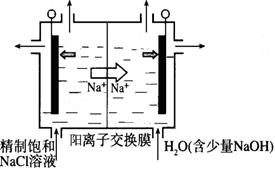
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因______________。
(3)ClO2对污水中Fe2+、Mn2+、S2—和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为_______;处理100 m3这种污水,至少需要ClO2 _______ mol 。
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )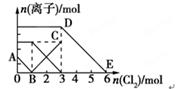
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2∶1∶3 |
下列过程中没有发生氧化还原反应的是
| A.天然气燃烧提供热量 |
| B.氯水使红色纸张褪色 |
| C.钢铁制品在空气中被腐蚀 |
| D.二氧化硫通人品红溶液中,溶液褪色 |

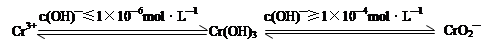


 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是 。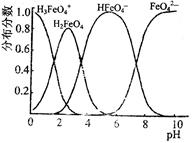
 Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。