题目内容
下列反应中,氧化剂与还原剂物质的量的关系为1:2的是
| A.4KI+O2+2H2O=4KOH+2I2 |
| B.2CH3COOH+Ca(ClO)2=2HClO+(CH3COO)2 Ca |
| C.I2+2NaClO3=2NaIO3+Cl2 |
D.MnO2+4HCl MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
D
解析试题分析:A、该反应中氧化剂是氧气,还原剂是KI,氧化剂与还原剂物质的量的关系为1:4,错误;B、该反应是非氧化还原反应,错误;C、该反应中氧化剂是氯酸钠,还原剂是碘,氧化剂与还原剂物质的量的关系为2:1,错误;D、该反应中氧化剂是二氧化锰,还原剂是HCl,其中参加反应的HCl中有一半作了还原剂,所以氧化剂与还原剂物质的量的关系为1:2,正确,答案选D。
考点:考查氧化还原反应中氧化剂、还原剂的判断

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下:
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(2)由溶液甲生成沉淀乙的离子方程式: ;
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
。
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )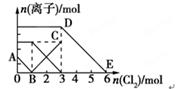
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=3mol |
| C.当通入2molCl2时,溶液中已发生的离子反应为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2∶1∶3 |
试管内壁的硫磺可以用热的KOH溶液来洗涤:3S+6KOH==K2SO3+2K2S+3H2O,该反应中,被氧化与被还原的硫原子个数比为
| A.1:2 | B.2:1 | C.1:1 | D.3:2 |
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性溶液中可以发生反应产生Cl2,下列关于混盐CaOCl2的有关判断不正确的是(NA为阿伏加德罗常数)
| A.该混盐在酸性溶液中产生1mol Cl2时转移的电子数为NA |
| B.该混盐的水溶液具有漂白性 |
| C.该混盐中氯元素的化合价为+1和-1价 |
| D.该混盐具有较强的还原性 |
下列过程中没有发生氧化还原反应的是
| A.天然气燃烧提供热量 |
| B.氯水使红色纸张褪色 |
| C.钢铁制品在空气中被腐蚀 |
| D.二氧化硫通人品红溶液中,溶液褪色 |
火法炼铜首先要焙烧黄铜矿,反应为:CuFeS2+O2 Cu2S+FeS+SO2 则下列说法正确的是
Cu2S+FeS+SO2 则下列说法正确的是
| A.CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 | B.每生成1molSO2转移6mol电子 |
| C.SO2既是氧化产物又是还原产物,FeS只是还原产物 | D.每转移1.2 mol电子,有0.3 mol氧气被还原 |