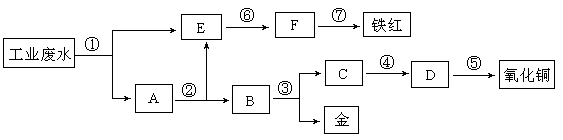
题目内容
(1)M由两种短周期元素组成,每个M分子含有18个电子,其分子球棍模型如图所示。测得M的摩尔质量为32g/mol。画出编号为2的原子结构示意图: 。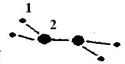
(2)已知1.0mol·L—1NaHSO3溶液的pH为3.5,加入氯水,振荡后溶液pH迅速降低。溶液pH降低的原因是 (用离子方程式表示)。
(3)在常温常压和光照条件下,N2在催化剂(TiO2)表面与H2O反应,生成1molNH3和O2时的能量变化值为382.5kJ,达到平衡后此反应NH3生成量与温度的实验数据如下表。则该反应的热化学方程式为 。
| T/K | 303 | 313 | 323 |
| NH3生成量/(10—1mol) | 4.3 | 5.9 | 6.0 |
(4)在溶液中,一定浓度的NH4+能溶解部分Mg(OH)2固体,反应如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq) +2NH3·H2O(aq)
Mg2+(aq) +2NH3·H2O(aq) 写出上述反应的平衡常数表达式
某研究性学习小组为探究Mg2+与NH3·H2O反应形成沉淀的情况,设计如下两组实验
| 实验① | 等体积1 mol/L氨水和0.1 mol/L MgCl2溶液混合 | 生成白色沉淀 |
| 实验② | 等体积0.1 mol/L氨水和1 mol/L MgCl2溶液混合 | 无现象 |
请分析实验①、②产生不同现象的原因: 。
(5)在室温下,化学反应I—(aq)+ ClO—(aq)=IO—(aq) + Cl—(aq)的反应物初始浓度、溶液中的氢氧根离子初始浓度及初始速率间的关系如下表所示:
| 实验编号 | I—的初始浓度 (mol·L—1) | ClO—的初始浓度 (mol·L—1) | OH—的初始浓度 (mol·L—1) | 初始速率v (mol·L—1· s—1) |
| 1 | 2 × 10—3 | 1.5 × 10—3 | 1.00 | 1.8 × 10—4 |
| 2 | a | 1.5 × 10—3 | 1.00 | 3.6 × 10—4 |
| 3 | 2 × 10—3 | 3 × 10—3 | 2.00 | 1.8 × 10—4 |
| 4 | 4 × 10—3 | 3 × 10—3 | 1.00 | 7.2 × 10—4 |
已知表中初始反应速率与有关离子浓度关系可以表示为v=" k" [I—]1 [ClO—]b [OH—]c(温度一定时,k为常数)。
①设计实验2和实验4的目的是 ;
②若实验编号4的其它浓度不变,仅将溶液的酸碱值变更为pH = 13,反应的初始速率v= 。
(1) (2分) (2)HSO3—+ Cl2 +H2O = 3H+ + SO42—+ 2Cl- (3分)
(2分) (2)HSO3—+ Cl2 +H2O = 3H+ + SO42—+ 2Cl- (3分)
(3)2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol (3分)
(4)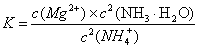 (2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(2分);从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2]。等合理答案均可] (2分)
(5)① ClO— 对反应速率的影响 (2分)
② 7.2 × 10—4 (2分)
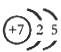
解析试题分析:(1)根据题意推断,M为N2H4,则1、2分别表示H、N,氮原子的核电荷数为+7,核外电子层结构为25;(2)亚硫酸盐与氯水发生氧化还原反应,生成强酸,反应式为HSO3—+Cl2+H2O=3H++SO42—+2Cl-;(3)读表可知,升高温度,平衡右移,说明正反应是吸热反应;根据原子守恒可知,1/2N2(g)+3/2H2O(l) NH3(g)+3/4O2(g) △H=+382.5kJ/mol,或2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=
NH3(g)+3/4O2(g) △H=+382.5kJ/mol,或2N2(g) +6H2O(l) = 4NH3(g) + 3O2(g) △H=+1530.0kJ/mol;(4)固体物质不能写进平衡常数表达式,则该反应的平衡常数K=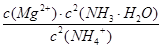 ;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v="7.2" × 10—4。
;从平衡常数表达式可以看出,当c(NH3·H2O)、c(Mg2+)改变相同的程度时,c2(NH3·H2O)对沉淀生成的影响更大[或①中c(Mg2+)?c2(OH—)≥Ksp[Mg(OH)2],而②中c(Mg2+)?c2(OH—)﹤Ksp[Mg(OH)2];(5)根据控制变量设计对比实验原则,实验1和2的目的是探究I—的浓度对反应速率的影响,实验2和4的目的是探究ClO—的浓度对反应速率的影响;由实验1和3可知,OH—的浓度对速率无影响,则实验4改编pH后反应速率与实验4相等,即v="7.2" × 10—4。
考点:考查物质结构、氧化还原反应、离子方程式、热化学方程式的书写、化学平衡常数的表达式及应用、沉淀的生成、化学反应速率及其影响因素、探究实验方案设计等相关知识。

某无色溶液,其中有可能存在以下离子:Na+、Ag+、Ba2+、Al3+、AlO2-、S2-、CO32-、SO32-、SO42-,现取该溶液进行有关试验,其结果如下: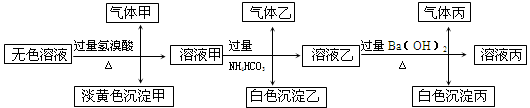
回答下列问题:
(1)生成沉淀甲的离子方程式: ;
已知气体甲由两种氧化物组成(不包括水蒸汽和HBr),请你设计实验逐一鉴别这两种成分,将所需试剂以及现象填入下表中(可不填满,表中每一行对应正确方可得分)
| 步骤 | 实验目的 | 试剂 | 现象 |
| 1 | | | |
| 2 | | | |
| 3 | | | |
| 4 | | | |
(2)由溶液甲生成沉淀乙的离子方程式: ;
(3)综上所述,该溶液中肯定存在的离子有: 。
(4)针对溶液中可能存在的离子,用实验验证其是否存在的方法是
。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(2)目前已开发出用电解法制取ClO2的新工艺。
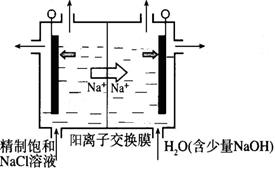
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因______________。
(3)ClO2对污水中Fe2+、Mn2+、S2—和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为_______;处理100 m3这种污水,至少需要ClO2 _______ mol 。
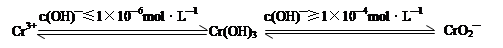

 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。