题目内容
5.写出下列反应的热化学方程式:(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(l)的△H=-571.6kJ/mol,氢气的燃烧热为285.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3=+226.7kJ•mol-1.
分析 (1)根据m=nM计算1mol水的质量为18g,进而计算1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热;氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ/mol;
(2)根据△H=反应物键能和-生成物键能和求算;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:C(s,石墨)+H2(g)=C2H2(g),反应热也进行相应的计算.
解答 解:(1)氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;
1g水蒸气转化成液态水放热2.444kJ,故18g水蒸气转化成液态水放出热量2.444kJ×18=44kJ,故反应H2(g)+$\frac{1}{2}$O2(g)═H2O(l)的反应热△H=-(241.8kJ/mol+44kJ/mol)=-285.8kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,故氢气的燃烧热为285.8kJ/mol;
故答案为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol;-571.6;285.8kJ/mol;
(2)△H=反应物键能和-生成物键能和=945KJ/mol+3×436KJ/mol-6×391KJ/mol=-93KJ/mol,即a=945+3×436-6×391=-93,
故答案为:a=945+3×436-6×391=-93;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
②2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,①×2+②×$\frac{1}{2}$-③×$\frac{1}{2}$可得:C(s,石墨)+H2(g)=C2H2(g),故△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3=+226.7kJ•mol-1,
故答案为:△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3=+226.7kJ•mol-1.
点评 本题考查热化学方程式的书写与反应热的计算、燃烧热等,题目难度中等,注意掌握热化学方程式的书写,燃烧热注意把握可燃物为1mol,生成稳定的氧化物.

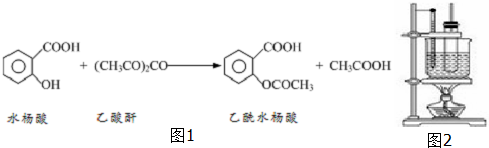
【反应原理】
如图1
【物质性质】
| 试剂 | 沸点(℃) | 溶解度 | 化学性质 |
| 乙酸酐 | 139 | 在水中逐渐分解 | 略 |
| 乙酰水杨酸 | 略 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
| 水杨酸 | 211 | 微溶于冷水,易溶于热水 | 略 |
| 乙酸 | 117.9 | 略 | 略 |
(1)物质制备:向大试管中依次加入2g水杨酸、5mL乙酸酐(密度为1.08g/mL)、5滴浓硫酸,振荡大试管至水杨酸全部溶解,将其放入盛有热水烧杯中,固定在铁架台上,在85℃~90℃条件下加热5~10min.装置如图2:
(2)产品结晶:取下大试管,置于冷水中冷却10min.待晶体完全析出,…抽滤,再洗涤晶体,抽干.
(3)产品提纯:将粗产品转移至150mL烧杯中,向其中慢慢加入试剂NaHCO3并不断搅拌至不再产生气泡为止.进一步提纯最终获得乙酰水杨酸1.8g.
(4)纯度检验:取少许产品加入盛有5mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色.
【问题讨论】
(1)写出水杨酸与碳酸氢钠溶液反应的化学反应方程式
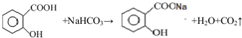 .
.(2)写出水杨酸与足量碳酸钠溶液反应后含苯环的生成物的结构简式
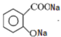 .
.(3)流程(1)装置图中长导管的作用冷凝回流和平衡压强.
(4)控制反应温度85℃~90℃的原因既保持有较高的反应速率又减少物质的挥发.
(5)流程(2)中证明晶体洗涤干净的操作方法:取最后一次洗涤滤液少许于试管中,滴加少量氯化钡,再滴加稀盐酸,若无沉淀出现则洗涤干净,反之则未洗涤干净
(6)流程(4)中溶液显紫色,可能的原因是产品中仍然可能有水杨酸.
(7)1mol乙酰水杨酸与氢氧化钠溶液反应可能,最多消耗3mol NaOH.
(8)实验中乙酰水杨酸的产率为69%(已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180).
| A. | 稀硫酸中加入铜粉:Cu+2H+═Cu2++H2↑ | |
| B. | 用FeCl3溶液刻蚀铜制印刷电路板:Cu+Fe3+═Cu2++Fe2+ | |
| C. | 向氢氧化钠溶液中通入过量CO2:CO2+2OH-═CO32-+H2O | |
| D. | 硫酸铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | H2CO3?H++HCO3-; HCO3-?H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | NaHS═Na++H++S2- | D. | CH3COOH?H++CH3COO- |
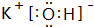 ,H的化学式为KHCO3;
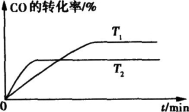
,H的化学式为KHCO3;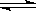 CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
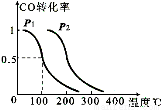
 =-483.6kJ/mol
=-483.6kJ/mol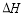 =+67.7kJ/mol
=+67.7kJ/mol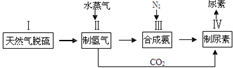
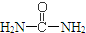 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.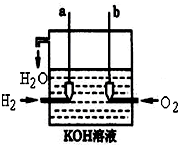 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的电池,其构造如图所示.两均为多孔碳制成,通入的气体由空隙中流出,并从电极表面放出.