题目内容
16.合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),一种工业合成氨,进而合成尿素的简易流程图如图: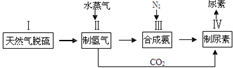
(1)步骤 II 中制氢气原理如下:
CH4(g)+H2O(g)?CO(g)+3H2(g) CO(g)+H2O(g)═CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是ac.
a.升高温度 b.充入 He c.加入催化剂 d.降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为2NH4HS+O2 $\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓.
(3)已知尿素的结构简式为
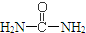 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.(4)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O.以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池中负极上的电极反应式是:CH3CH2OH-12e-+16OH-═2CO32-+11H2O.
(5)已知 CO2+2NH3$\stackrel{一定条件}{→}$CO(NH2)2+H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成400吨尿素.
分析 (1)根据影响化学反应速率的因素判断,一般增大浓度、增大压强、升高温度,反应的反应速率增大;
(2)根据元素守恒和电子得失守恒写出化学方程式;
(3)尿素中含有C、H、O、N四种元素,形成有离子键的物质,则有铵根离子,根据同分异构体的特点写出有关化学式;
(4)根据元素守恒及题中的反应物和生成物写出化学方程式,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池中,负极上CH3CH2OH失去电子,发生氧化反,可写出电极反应式;
(5)根据化学方程式,利用元素守恒,可计算出尿素的质量.
解答 解:(1)根据影响化学反应速率的因素可知,升高温度和加入催化剂都可以增加反应速率,充入氦气各物质的浓度没变,所以反应速率不变,减小压强反应速率减小,
故答案为:ac;
(2)根据元素守恒及题中的反应物和生成物可知化学方程式为:2NH4HS+O2 $\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓,
故答案为:2NH4HS+O2 $\frac{\underline{\;一定条件下\;}}{\;}$2NH3•H2O+2S↓;
(3)尿素中含有CHON四种元素,形成有离子键的物质,则有铵根离子,根据同分异构体的特点写出有关化学式为NH4OCN,
故答案为:NH4OCN;
(4)根据元素守恒及题中的反应物和生成物写出化学方程式为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O,在CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池中,负极上CH3CH2OH失去电子,发生氧化反应,可写出电极反应式为CH3CH2OH-12e-+16OH-═2CO32-+11 H2O,
故答案为:2CO2+6H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CH3CH2OH+3H2O;CH3CH2OH-12e-+16OH-═2CO32-+11H2O;
(5)根据化学方程式CH4(g)+H2O(g)?CO(g)+3H2(g) 和 CO(g)+H2O(g)=?CO2(g)+H2(g),CO2+2NH3$\stackrel{一定条件}{→}$CO(NH2)2+H2O,及元素守恒可知CH4~4H2 ~$\frac{8}{3}$NH3~$\frac{4}{3}$CO(NH2)2,
根据CH4~4H2 ~$\frac{8}{3}$NH3~$\frac{4}{3}$CO(NH2)2
16 80
100t×80% xt
x=$\frac{80×100×80%}{16}$t=400t
故答案为:400.
点评 本题主要考查了影响化学反应速率因素、化学方程式的书写、根据化学方程式的计算等知识,有一定的综合性,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 类铅元素原子的最外层电子数为6 | B. | 其常见价态为+2、+3、+4 | ||
| C. | 它的金属性比铅强 | D. | 它的原子半径比铅小? |
| A. | 1 mol 苯含有6 NA个C-H键 | |
| B. | 常温常压下,22.4 L H2O含有3NA个原子 | |
| C. | 1L 0.1 mol•L-1NaHCO3溶液中含有0.1NA个HCO3- | |
| D. | 23g Na与足量H2O反应完全共转移2NA个电子 |
(1)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol.若1g水蒸气转化成液态水放热2.444kJ,则反应2H2(g)+O2(g)═2H2O(l)的△H=-571.6kJ/mol,氢气的燃烧热为285.8kJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2 599kJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变(列出简单的计算式):△H=2△H1+$\frac{1}{2}$△H2-$\frac{1}{2}$△H3=+226.7kJ•mol-1.
 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如图,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如图,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
| A. |  火药使用 火药使用 | B. |  粮食酿酒 | C. |  转轮排字 | D. |  铁的冶炼 |
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1;反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2;在不同温度时K1、K2的值如表:| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H>0,CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2.0;若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为$\frac{2}{3}$mol•L-1;
②下列措施中能使平衡时K增大的是A(填选项字母).
A.升高温度 B.增大压强C.再充入一定量的CO2 D.再加入一定量铁粉.
| A. | 聚乙烯分子中含碳碳双键 | B. | 油脂的皂化反应属于加成反应 | ||
| C. | 丁烷有3种同分异构体 | D. | 以淀粉为原料可以制备乙醇 |
| A. | 25mol | B. | 1.56mol | C. | 1mol | D. | 0.1mol |