题目内容
4.有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如图所示,其中B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰.请回答:
(1)D的分子式为C5H10O;
(2)E中所含官能团的名称为羧基;
(3)Ⅲ的反应类型为ab(填字母序号);
a.还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)写出D与新制氢氧化铜悬浊液反应的化学方程式(CH3)2CHCH2CHO+2Cu(OH)2→Cu2O↓+2H2O+(CH3)2CHCH2COOH;
(5)C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为
 ;
;(6)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,它们的结构简式为…
 、和
、和 ;
;(7)E有多种同分异构体,其中一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为
 .
.
分析 B可在NaOH乙醇溶液加热的条件下反应生成A,则A中含有C=C,有机物A为烃类化合物,质谱图表明其相对分子质量为70,根据商余法,$\frac{70}{14}$=5,则A的分子式为C5H10,B的分子式为C5H11Br,D能与银氨溶液反应,说明D中含有-CHO,E中含有-COOH,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,说明含有4种不同的H原子,D应为 CH3-CH(CH3)-CH2-CHO,E应为 CH3-CH(CH3)-CH2-COOH,C为 CH3-CH(CH3)-CH2-CH2OH,B为CH3-CH(CH3)-CH2-CH2Br,则A为CH3-CH(CH3)-CH=CH2,结合有机物的结构和性质解答该题.
(1)D应为 CH3-CH(CH3)-CH2-CHO,据此书写分子式;
(2)E应为 CH3-CH(CH3)-CH2-COOH,根据结构简式解答;
(3)有机物加氢的反应为还原反应;
(4)D与新制氢氧化铜悬浊液反应,D中醛基被氧化成羧基;
(5)C为 CH3-CH(CH3)-CH2-CH2OH,E应为 CH3-CH(CH3)-CH2-COOH,酸脱羟基醇脱氢,发生酯化反应;
(6)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,则它们的结构简式为 、
、 ;
;
(7)能发生银镜反应,说明含有醛基,能与足量金属钠生成氢气,不能发生消去反应,说明含有-OH,且与羟基相连的碳上没有氢原子.
解答 解:B可在NaOH乙醇溶液加热的条件下反应生成A,则A中含有C=C,有机物A为烃类化合物,质谱图表明其相对分子质量为70,根据商余法,$\frac{70}{14}$=5,则A的分子式为C5H10,B的分子式为C5H11Br,D能与银氨溶液反应,说明D中含有-CHO,E中含有-COOH,B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰,说明含有4种不同的H原子,D应为 CH3-CH(CH3)-CH2-CHO,E应为 CH3-CH(CH3)-CH2-COOH,C为 CH3-CH(CH3)-CH2-CH2OH,B为CH3-CH(CH3)-CH2-CH2Br,则A为CH3-CH(CH3)-CH=CH2,
(1)由以上分析可知D为CH3-CH(CH3)-CH2-CHO,分子式为C5H10O,故答案为:C5H10O;
(2)E为 CH3-CH(CH3)-CH2-COOH,所含官能团-COOH,名称为羧基,故答案为:羧基;
(3)反应Ⅲ是D物质(CH3)2CHCH2CHO与氢气发生加成反应生成C物质(CH3)2CHCH2CH2OH,也属于还原反应,故答案为:ab;
(4)D与新制氢氧化铜悬浊液反应,D中醛基被氧化成羧基,反应方程式为(CH3)2CHCH2CHO+2Cu(OH)2→Cu2O↓+2H2O+(CH3)2CHCH2COOH,
故答案为:(CH3)2CHCH2CHO+2Cu(OH)2→Cu2O↓+2H2O+(CH3)2CHCH2COOH;
(5)C和E可在一定条件下反应生成F,F为有香味的有机化合物,发生酯化反应,酸脱羟基醇脱氢,所以该反应的化学方程式为:
故答案为: ;
;
(6)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,则它们的结构简式为 、
、 ,
,
故答案为: 、
、 ;
;
(7)(CH3)2CHCH2COOH的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,含有-CHO与-OH,且不能发生消去反应,其结构简式为: ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断,涉及卤代烃、醇、醛、羧酸的性质与转化,计算确定A的分子式是关键,再结合反应条件进行推断,侧重考查学生分析推理能力,熟练掌握常见官能团的结构及其性质,题目难度中等.

| A. | 该氨水显弱碱性 | |
| B. | 加水稀释过程中,c(H+)/c(OH-)的值减小 | |
| C. | 与同温下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+) | |
| D. | 加入少量NH4Cl 固体,溶液中水的电离平衡:H2O?H++OH-向右移动 |
H2CrO4═HCrO${\;}_{4}^{-}$+H+
HCrO${\;}_{4}^{-}$?CrO${\;}_{4}^{2-}$+H+ Ka=3.2×10-7mol.L-1
下列判断正确的是( )
| A. | 0.05 mol•L-1H2CrO4溶液的pH=1 | |
| B. | 向100 mL0.l mol•L-1 H2CrO4溶液中滴入几滴NaOH溶液,溶液中$\frac{c(Cr{O}_{4}^{2-})}{c(HCr{O}_{4}^{-})}$变大 | |
| C. | Na2CrO4溶液中:c(Na+)+c(H+)=c(CrO42-)+c(HCrO4-)+c(OH-) | |
| D. | 等浓度的:NaHCrO4溶液与NaHCO3溶液中,水的电离程度前者大 |
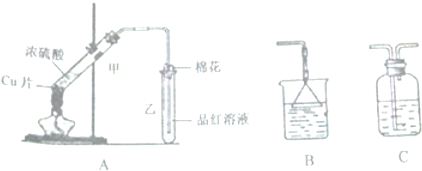
 利用图所示装置进行以下实验,能得到相应实验结论的是( )
利用图所示装置进行以下实验,能得到相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 稀硫酸 | 石灰石 | 澄清石灰水 | 制二氧化碳并吸收尾气 |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| C | 稀盐酸 | Na2SO3 | H2S溶液 | SO2具有还原性 |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
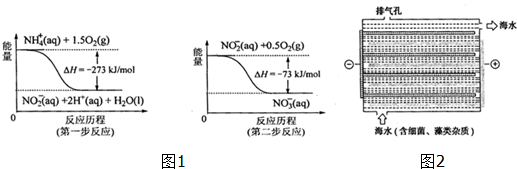
Ⅰ.饮用水中含所有一定浓度的NO3+将对人体健康产生危害,NO3+能氧化人体血红蛋白中的Fe(H),使其失去携氧功能.
(1)饮用水中的NO3+主要来自NO4+.已知在微生物作用下,NO4+经过两步反应被氧化成NO3+.两步反应的能量变化示意图如图1,试写出1molNO4+(ap)全部氧化成NO3+(ap)的热化学方程式NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)△H=-346kJ•mol-1.
(2)用H2催化还原法也可见底饮用水中NO3+的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为5H2+2NO3-$\frac{\underline{\;催化剂\;}}{\;}$N2+4H2O+2OH-.
(3)现测得某地水质试样中所含水溶性无机离子的化学组及其平均浓度如下表:根据表中数据计算该试样的pH=4
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度(mol/L) | 3×10-6 | 7×10-6 | 2×10-5 | 3×10-5 | 5×10-5 | 2×10-5 |
(1)通常用明矾[K2SO4•Al2(SO4)3•24H2O]作混凝剂,降低浊度.明矾水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+.
(2)对海水进行消毒和灭藻处理时常用如图2所示NaClO的发生装置.
①装置中由NaCl转化为NaClO的化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+Cl2↑+H2↑、2NaOH+Cl2=NaClO+NaCl+H2O.
②海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3.生成CaCO3的离子方程式是Ca2++HCO3-+OH-=CaCO3↓+H2O.
③若每隔5-10min倒换一次电极电性,可有效地解决阴极的结垢问题.试用电极反应式并结合必要的文字进行解释阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的.
| A. | 加热氯化铁溶液,溶液颜色变深与盐类水解有关 | |
| B. | NaHS溶液水解方程式为:HS-+H2O?H2S+OH- | |
| C. | Na2SO3溶液中,c(OH-)=c(H+)+c(HSO3-)+c(H2SO3) | |
| D. | 0.1 mol•L-1的CH3COOH溶液和0.1 mol•L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
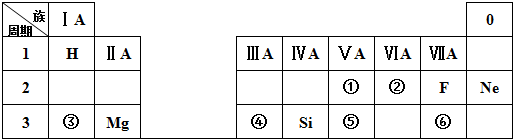
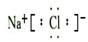 .
.